3. Calor y temperatura
 |
En el lenguaje cotidiano solemos confundir los términos calor y temperatura. Así, cuando hablamos del calor que hace en el verano o lo mal que saben los refrescos calientes, realmente nos referimos a la temperatura, a la mayor o menor temperatura del aire o de los refrescos. A esa magnitud que nos mide el termómetro. Pero entonces....
¿Qué es el calor?
Cuando se ponen en contacto dos sustancias a distinta temperatura, evolucionan de tal forma que disminuye progresivamente la del cuerpo que está a mayor temperatura y aumenta la del que está a menor, hasta que al final los dos tienen la misma.
Esto lo podemos observar al echar un cubito de hielo a un refresco a temperatura ambiente. La temperatura del cubito aumenta y la del refresco disminuye. De forma cotidiana decimos que el refresco se "enfría" y cubito se "calienta" y termina convirtiéndose en agua.
El calor tiene mucho que ver con las sustancias que se encuentran a diferente temperatura. Podemos concluir que la sustancia a mayor temperatura ha cedido calor a la sustancia que tenía menor temperatura y provoca que ésta aumente.
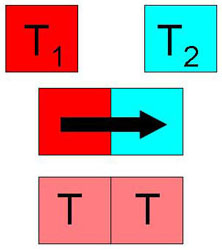 |
Por lo tanto, el calor no es algo que esté almacenado en un cuerpo. Un objeto no contiene mucho o poco calor. Lo que sí es correcto es decir que un objeto tiene una temperatura muy elevada o muy baja, ya que nos está indicando el termómetro que ese cuerpo tiene mucha o poca energía térmica, que el grado de agitación de sus partículas (su energía cinética) es elevado o pequeño.
Si un cuerpo tiene una temperatura de 80 ºC y otro en contacto con él está a una temperatura de 20 ºC, pasa energía del primero al segundo hasta igualarse las temperaturas. A esa energía que ha pasado de un cuerpo a otro se denomina calor: una catarata es agua que pasa de un sitio a otro porque están a distinta altura, y de forma similar el calor es la energía que pasa de un cuerpo a otro porque están a distinta temperatura.
Concepto de calor
Se define calor como la medida de la energía que se transmite de un cuerpo de mayor temperatura a otro de menor temperatura.
 |
Equilibrio térmico
Predice qué pasará con la temperatura al mezclar 100 cm3 de agua caliente con otros 100 cm3 a temperatura ambiente.
Diseña un experimento que te permita contrastar tus predicciones y realízalo en el laboratorio. ¿Se confirman tus predicciones?
¿Cuál será la temperatura de la mezcla que se ve en la imagen?
Unidades de energía
Las dos formas de transmitir energía entre los cuerpos, calor y trabajo, se miden con la misma unidad, el julio (J). Para la medida del calor también se utiliza una antigua medida denominada caloría (cal).
Una caloría (cal) es la cantidad de calor que hay que suministrar a 1 g de agua para que se eleve su temperatura 1 ºC.
La equivalencia entre estas dos unidades es: 1 cal = 4,18 J.
Calentando agua (I)
¿Cuánto calor medido en calorías se ha de proporcionar a 200 g de agua para elevar la temperatura de 20 a 21 ºC?
Calentando agua (II)
Si quieres calentar un kilogramo de agua desde 20 a 25 ºC, ¿qué cantidad de energía en forma de calor tienes que comunicar? Expresa el resultado en julios, calorías y kilocalorías.
a) Cuando un objeto aumenta su temperatura aumenta la velocidad de sus partículas.
Verdadero Falso
b) El agua en ebullición tiene más calor que el agua fría.
Verdadero Falso
c) Para aumentar la temperatura de un objeto hay que proporcionarle calor.
Verdadero Falso
Energía cinética y calor
Fíjate en la tira cómica siguiente, en la que se hace un chiste con la transformación de energía cinética en calor. Indica otros casos en los que se produzca esa transformación.

Las calorías alimentarias
 |
La normativa europea obliga a que todos los alimentos indiquen su composición y también su poder energético, es decir, la energía que produce su metabolización en el cuerpo humano.
La necesidad de energía de las personas tiene un valor medio de unas 2000 kcal diarias. Si se quiere perder peso, hay que seguir una dieta equilibrada que proporcione todos los nutrientes necesarios pero que aporte menos de esa cantidad, y a la vez conviene hacer ejercicio para consumir más energía de lo habitual.
Si en algún momento lees o oyes hablar de calorías en un entorno alimentario, ten en cuenta que se trata de kilocalorías.