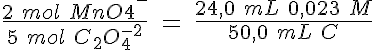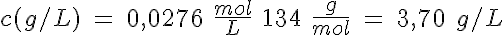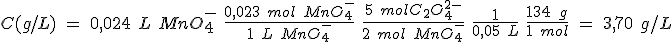5. Volumetrías redox
Al igual que sucede con los ácidos y las bases, se puede conocer la concentración de una disolución al hacerla reaccionar en un proceso redox con otra cuya concentración esté determinada con exactitud. Este método se denomina valoración redox.
Las valoraciones redox requieren el mismo tipo de cálculos que has realizado en las reacciones ácido-base, e igualmente es necesario determinar el punto final de la valoración mediante indicadores redox.
Un indicador redox es una sustancia cuyo color es intenso, bien definido, y distinto en sus estados oxidado y reducido. Como en las reacciones ácido-base, se añaden unas gotas de disolución de indicador al erlenmeyer. Cuando se realiza la reacción redox y se alcanza el punto final, la siguiente gota añadida desde la bureta supone un exceso de reactivo, que reacciona con el indicador y produce un cambio de color observable.
En la siguiente tabla tienes una lista de algunos indicadores redox, y sus respectivos colores en las formas reducida y oxidada:
| Indicador | Color reducido | Color oxidado |
| Azul de Metileno | Azul | Incoloro |
| Difenillamin-Sulfato de Bario | Incoloro | Púrpura |
| Nitro-Ferroína | Rojo | Azul-Pálido |
| Rojo neutro | Rojo | Incoloro |
| Tionina | Violeta | Incoloro |
| Ferroína | Rojo | Azul-Pálido |
|
|
Algunas sustancias sirven como autoindicadores. Por ejemplo, el permanganato de potasio puede ser usado como oxidante y como indicador redox al mismo tiempo. Esta sustancia tiene un color rosa muy pálido cuando está reducido, y un color violeta fuerte cuando está oxidado. De esta forma, cuando se hace una valoración con permanganato de potasio, la primera gota en exceso de oxidante causará la aparición de este color violeta, indicando el final de la valoración.
En el vídeo puedes ver cómo se va decolorando el permanganato al añadirlo a una disolución con la que reacciona. En el momento en que ya no haya reacción, permanecerá el color violeta.
Otros indicadores son específicos, reaccionando con uno de los reactivos, como sucede por ejemplo con el almidón, que produce un color azul intenso cuando reacciona con el iodo, o el ion tiocianato (SCN-), que reacciona con el hierro (III) produciendo un color rojo.
Valoraciones redox
Utilizando el simulador siguiente puedes realizar tres valoraciones redox diferentes. El procedimiento es el mismo que seguiste en el caso del vinagre.
Comenzando por la permanganimetría, vas a determinar la concentración de una disolución de iones Fe(II). En primer lugar, haz una valoración aproximada, añadiendo de 5 mL en 5 mL hasta que cambie el color de forma permanente. Repite el proceso añadiendo la cantidad que consideres adecuada de golpe, y después de mL en mL. Por último, tras añadir el volumen adecuado de golpe, vas añadiendo gota a gota. Con el dato definitivo del volumen añadido, calcula la concentración a determinar.
Repite el proceso con las otras dos valoraciones.