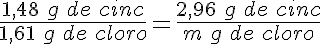1. La teoría atómica de Dalton
Leyes experimentales en masa
 |
A finales del siglo XVIII, el trabajo experimental de Lavoisier, que explicaba la naturaleza de la materia sobre la base de datos obtenidos en el laboratorio, terminó con mil años de alquimia en busca de la piedra filosofal y la transmutación de los metales en oro.
En 1789 Lavoisier, el padre de la Química moderna, publicó su "Tratado elemental de Química", en el que detalló que había medido las masas de las sustancias que intervenían en una reacción química, y comprobado que aunque cambiaba la masa de cada una de ellas, la masa total no lo hacía, permaneciendo constante. Es decir, la masa que desaparece de reactivos es la misma que se forma de productos.
Entre 1794 y 1804, Proust comprobó que cuando dos sustancias se combinan entre sí para formar una tercera, la proporción de combinación en masas entre ellas siempre tiene el mismo valor.
Como los elementos se combinan en una proporción constante, la composición de cada sustancia es fija, y el porcentaje en masa que hay en ella de cada elemento (su composición centesimal) también.
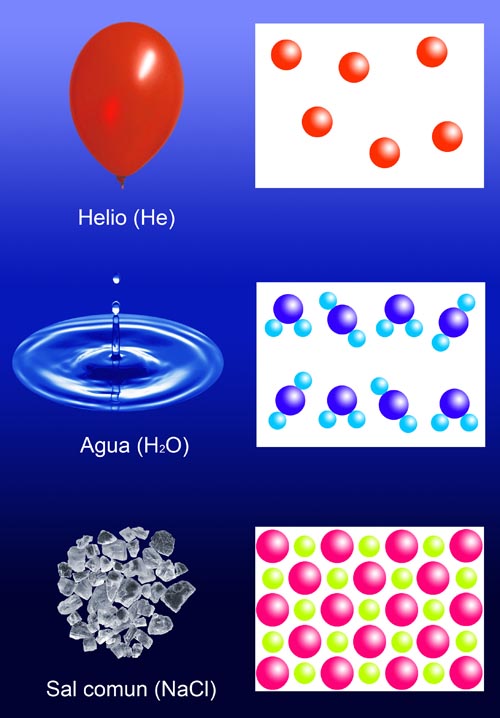 |
Teoría atómica de Dalton
Dalton retomó el concepto de átomo de la Grecia clásica e hizo una serie de suposiciones sobre la estructura y composición de la materia con el fin de explicar las leyes ponderales. La teoría atómica de Dalton, publicada en 1808, indica que:
- Las sustancias están formadas por partículas indivisibles y muy pequeñas llamadas átomos.
- Todos los átomos de una sustancia simple son iguales entre sí; en particular, tienen la misma masa.
- Los átomos se unen entre sí, formando sustancias simples si se unen átomos iguales o compuestas si se unen átomos distintos, pero siempre en una proporción fija para cada sustancia.
- En las reacciones químicas los átomos no cambian: simplemente, se unen de forma diferente en los reactivos y en los productos, pero el número de cada tipo de átomos no se modifica.
 |
 |
Reaccionando cloro con cinc
La proporción de combinación entre cloro y cinc es siempre la misma, como has visto en el ejercicio anterior. Si reaccionan 4,44 g de cinc ¿qué masa de cloruro de cinc se obtiene?
|
6,18
| |
|
3,09
| |
|
9,27
| |
|
12,36
|