5.1 Segundo y tercer principio de la Termodinámica
 |
Segundo principio de la Termodinámica
La entropía está relacionada con los otros dos principios de la Termodinámica. Como en general los estados desordenados son más probables que los ordenados, un sistema aislado que no esté en equilibrio evoluciona espontáneamente hacia estados de máximo desorden, que son los más probables.
Se puede enunciar el segundo principio diciendo que cualquier proceso que ocurre espontáneamente produce un aumento de entropía del Universo (ΔSU ≥ 0). En algunos casos puede producirse una disminución de entropía en el sistema, pero la del entorno aumentará al menos lo mismo.
Tercer principio de la Termodinámica
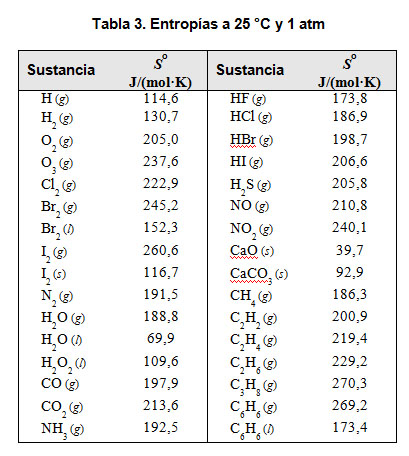
Está relacionado con los valores que toma la entropía. A diferencia de la energía interna o de la entalpía, es posible conocer el valor de la entropía de una sustancia a una temperatura y presión determinadas, de manera que se tabulan las entropías molares estándar (a la presión de 1 atm y a la temperatura de 25 ºC).
El tercer principio de la Termodinámica establece que la entropía de un elemento puro en su forma condensada estable, formando una red sólida cristalina sin defectos, es cero cuando la temperatura tiende a cero.
Según este principio, todas las entropías molares estándar son positivas, proporcionando un origen de entropías. Pero como no se puede alcanzar un estado de orden absoluto, con entropía cero, otra forma de plantearlo es decir que no se puede llegar al cero absoluto de temperaturas.
Como ocurre con la entalpía estándar de reacción, la variación de la entropía en una reacción química puede determinarse a partir de las entropías molares estándar de reactivos y productos:
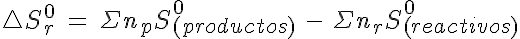
La degradación de la energía
El significado energético de la entropía es muy importante, ya que es una medida de la cantidad de energía que no se puede extraer de un sistema: al aumentar la entropía, la energía está menos concentrada (o más distribuida), por lo que resulta más difícil extraerla para utilizarla.
La entropía determina la proporción de energía que no puede liberarse. Éste es el gran problema de la sociedad actual, ya que las fuentes de energía se van agotando. Pero ¿por qué es un problema si la energía total del Universo permanece constante? Porque cada vez va aumentando la proporción de energía que no resulta útil, ya que no se puede liberar. Es decir, la energía se va degradando a formas de mayor entropía.
Un trozo de carbón se quema, y la energía de los productos es la misma que la que tenían el trozo de carbón y el oxígeno que han reaccionado, pero es mucho más difícil extraerla de esas sustancias para volverla a utilizar.
¿Todo tiene que estar ordenado?
Te va a resultar fácil ver la influencia del segundo principio a tu alrededor, porque los cambios en la naturaleza actúan en la dirección del desorden: los objetos se descolocan, las cosas se desordenan, la ropa se ensucia. Y para tener las cosas a punto es preciso estar constantemente arreglando y limpiando el polvo y ordenando. Al fin y al cabo ¡ser desordenado es seguir la tendencia de la Naturaleza!
|
La entropía no cambia en el proceso.
| |
|
-118,8 JK-1mol-1
| |
|
118,8 JK-1mol-1
| |
|
-237,6 JK-1mol-1
|
Clausius y la entropía
El término entropía lo introdujo el físico alemán Clausius para representar el grado de uniformidad con que está distribuida la energía, sea de la clase que sea. Cuanto más uniforme sea la distribución, mayor es la entropía. Cuando la energía está distribuida de manera perfectamente uniforme, la entropía es máxima para el sistema en cuestión.
Clausius observó que cualquier diferencia de energía dentro de un sistema tiende siempre a igualarse por sí sola. Clausius afirmó que en la naturaleza era regla general que las diferencias en las concentraciones de energía tienden a igualarse.
James Bond y la termodinámica
|
|
"El hombre de la pistola de oro" es el título de una película de James Bond, protagonizada en 1974 por Roger Moore y en la que hace de villano Cristopher Lee, famoso por sus interpretaciones de Drácula.
En esta película hay una secuencia muy conocida, que puedes ver en el trailer, en la que un coche salta sobre un río haciendo una pirueta muy espectacular. También hay una frase no menos llamativa del villano, que le dice al agente secreto británico "Cuidado señor Bond, que el helio líquido está a 453 grados bajo cero".
Si el cero absoluto está en -273 K ¿qué es eso de 453 bajo cero? Puede ser que el traductor no se aclarase con el número, o que al autor del guión le diese igual el tercer principio de la Termodinámica (¡eso es seguro!).
Pero se trata de algo distinto: en realidad, se está hablando de grados Farenheit, que todavía se usaban en Inglaterra 1952 cuando sir Ian Fleming escribió "Casino Royale", la primera novela del agente secreto. Si se hace la transformación, quitando 32 a la temperatura en Farenheit y dividiendo por 1,8, el resultado es -269,4 C, es decir, 3,6 K, temperatura a la que el helio se encuentra en estado líquido.