2.1 El estado de transición
|
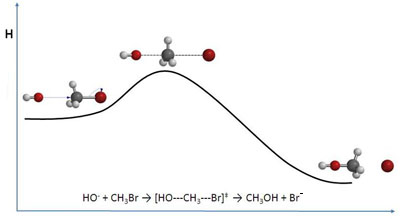
La teoría de las colisiones se completa con la teoría del estado de transición (Eyring, 1935), en la que se supone que la reacción transcurre a través del llamado complejo activado (agregado de átomos más complejo que una molécula sencilla y con mayor contenido energético que los reactivos y productos) o complejo de transición (intermedio entre los reactivos y productos).
La formación del complejo activado supone que hay que remontar una barrera energética, cuya altura es la energía de activación, Ea, para que la reacción pueda producirse. Es evidente que si esta energía de activación es pequeña, habrá muchas moléculas con energía cinética mayor, por lo que muchos choques serán eficaces y será grande la velocidad de reacción. En cambio, si Ea es grande, muy pocas moléculas tendrán suficiente energía cinética para remontar la barrera, con lo que casi todos los choques serán ineficaces y la velocidad de reacción muy pequeña.
El complejo de transición es un agregado constituido por las moléculas reaccionantes, y en el que algunos de los enlaces primitivos se han debilitado (o incluso roto) y se han empezado a formar nuevos enlaces. Como tiene acumulada toda la energía de las moléculas reaccionantes, es muy inestable, y se descompone inmediatamente originando los productos de la reacción.
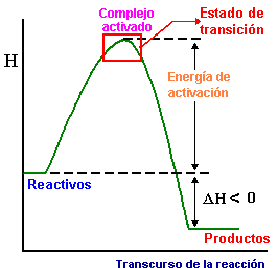
Puedes ver en las imágenes la representación de la barrera de energía en un diagrama entálpico, en cuya cima se sitúa el complejo activado.
 |
 |
Barreras de energía y carácter térmico
Observa que la energía de activación mínima para una reacción endotérmica tiene que ser superior a la entalpía de la reacción, mientras que en una reacción exotérmica puede ser nula, por lo que suelen ser más rápidas.
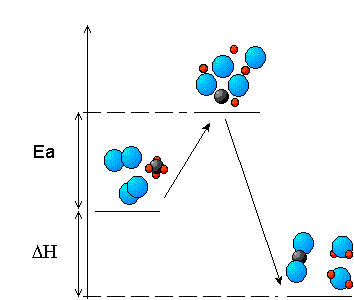
Las barreras de energía de las reacciones directa (R → P) e inversa (P → R) están relacionadas entre sí determinando el valor de la entalpía de reacción, ΔH. A partir de la gráfica, puedes ver que es la diferencia de las barreras de energía de las reacciones directa e inversa:

 |
|
Se trata de una reacción de combustión.
| |
|
La barrera de energía es negativa.
| |
|
La barrera de energía de la reacción inversa es menor que la de la reacción directa.
| |
|
El complejo activado es la sustancia de menor energía.
|
|
|
Reacciones exotérmicas muy lentas
En muchos casos es necesario iniciar las reacciones exotérmicas, ya que la energía desprendida en forma de calor al reaccionar las primeras moléculas hace que aumente la temperatura y el contenido energético del resto de reactivos, que superan la barrera de energía con más facilidad.
Por esa razón, hay reacciones espontáneas muy exotérmicas que, sin embargo, no se observan a temperatura ambiente, ya que la energía de activación es muy grande. Pero una vez que se provocan mediante una pequeña aportación de energía, pueden desarrollarse a tal velocidad que incluso llegan a ser explosivas.
