2. Modelos teóricos
|
|
Hasta ahora has visto los aspectos fundamentales de la cinética
experimental, pero es muy importante que sepas por qué se producen las
reacciones químicas, y seas capaz de interpretar las leyes
experimentales. Para ello, has de conocer los modelos teóricos que
explican a escala molecular lo que ocurre al producirse una reacción
química e interpretar la rapidez o lentitud de esa reacción.
Se utilizan dos teorías, de forma que la primera es muy sencilla e intuitiva, y la segunda complementa sus aspectos energéticos:
-
Teoría de las colisiones o de los choques, basada en la teoría cinética de la materia.
-
Teoría del estado de transición, que se centra en la formación del complejo activado o complejo de transición.
Teoría de las colisiones
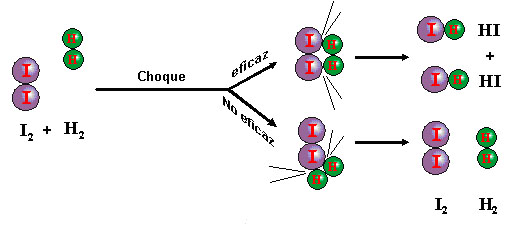
Propuesta por Lewis en 1920, propone que las reacciones químicas tienen lugar a través de una colisión entre partículas que produce la formación de moléculas que no estaban presentes antes del choque. Las moléculas pueden ser nuevas porque unos enlaces se han roto, porque se han formado enlaces nuevos o por ambas cosas a la vez.
Ahora bien, dos moléculas pueden chocar entre sí y no verificarse reacción alguna. Para que un choque sea eficaz, esto es, se produzca reacción, hacen falta al menos dos condiciones:
-
Que las moléculas tengan suficiente energía cinética, para que al chocar puedan romperse algunos enlaces. Estas moléculas se llaman moléculas activadas, y la energía mínima requerida se llama energía de activación.
-
Que el choque se verifique con una orientación adecuada. Aunque las moléculas tengan la suficiente energía, puede suceder que el choque no sea eficaz, por tener lugar con una orientación desfavorable, como puedes ver en la imagen.
|
|
Orden de reacción y mecanismo de reacción
Si la reacción es elemental, los coeficientes de cada reactivo en la ecuación de velocidad coinciden con los
estequiométricos: los reactivos
se transforman por choque directamente en productos, y el mecanismo de reacción es simple. En caso contrario, la reacción se produce en fases, formándose
sustancias intermedias que reaccionan para transformarse en productos,
y hay un mecanismo de reacción complejo.
La molecularidad es el número de partículas que choca para producir la reacción. Si la reacción tiene un mecanismo de reacción simple, coincide con el orden de reacción. La molecularidad no suele ser mayor de tres, ya que es muy improbable que choquen más de tres moléculas con la energía suficiente y la orientación adecuada.
Verdadero Falso
Verdadero Falso
Verdadero Falso
|
v=k[A][B]
| |
|
v=k[A]2[B]
| |
|
v=k[A][B]2
| |
|
v=k[A]2[B]2 |