3.1 Influencia de la temperatura
El dato experimental más inmediato que se conoce sobre las reacciones químicas es que la velocidad de reacción aumenta con la temperatura. En general, al aumentar la temperatura unos 10 Kelvin, la velocidad varía en un factor comprendido entre 1,5 y 5.
No todas las moléculas de los reactivos tienen la misma energía cinética,
sino que está distribuida al azar entre todas ellas, de forma que la
mayoría tiene una energía cercana a un valor medio, pocas tienen
energías grandes y también pocas tienen energías pequeñas. Al aumentar
la temperatura, se hace mayor el porcentaje de moléculas con energías
grandes y también la energía media de las moléculas, con lo que una fracción mayor de partículas tiene energía suficiente para superar la barrera de energía, por lo que aumenta la velocidad de reacción.
|
|
La relación entre la constante de velocidad K y la temperatura se descubrió por procedimientos experimentales (Arrhenius, 1899). Esta relación se conoce con el nombre de ley de Arrhenius y su expresión matemática es:
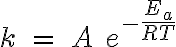
donde A es una constante llamada factor de frecuencia, R la constante de los gases ideales (expresada en unidades de energía), T la temperatura absoluta y Ea la energía de activación de la reacción.
La inclusión del término Ea en la expresión se debe a que, como ya sabes, prácticamente en todas las reacciones es necesario que las moléculas o partículas que colisionan (reaccionan) lo hagan "activamente", esto es, con suficiente energía como para romper sus enlaces.
Cinética de una reacción de descomposición
El simulador te va a permitir determinar cómo afectan la cantidad de partículas, la temperatura, el volumen y la energía de activación a la velocidad de la reacción de disociación de A en 2 de B.
Ve modificando los factores uno a uno y determina las condiciones más adecuadas para que la reacción sea lo más rápida o lo más lenta posible.
Calculando energías de activación
Si desarrollas la ley de Arrhenius en forma logarítmica a dos temperaturas diferentes, se transforma en:


Restando las dos igualdades y operando resulta que:

Esta expresión permite calcular la energía de activación sabiendo las constantes de velocidad para dos temperaturas (valores que se determinan experimentalmente como has visto antes).
¿Cuánto vale la barrera de energía?
Para saberlo, solamente has de considerar que hay muchas reacciones que aproximadamente duplican su velocidad al aumentar la temperatura en 10 K, partiendo de temperatura ambiente. Si la velocidad de reacción es doble, es que la k se ha hecho doble. Sustituyendo en la ecuación que acabas de ver:
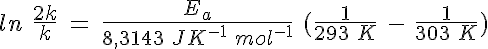
Resolviendo, la energía de activación en esas condiciones es de 51,2 kJ.
Ley de Arrhenius, temperatura y energía de activación
Justifica según la ecuación de Arrhenius la influencia de la temperatura y de la energía de activación en la velocidad de reacción.
Cinética de una reacción real
La deshidrohalogenación del cloroetano se ha estudiado de forma que se sabe que es de orden uno y se conocen los valores de la energía de activación y del factor preexponencial. Es interesante determinar el tiempo que le cuesta reducirse a la centésima parte la cantidad de reactivo que se pone a reaccionar a diferentes temperaturas; es decir, el tiempo para el cual ha reaccionado el 99% del cloroetano según el proceso:
CH3-CH2Cl (g) → CH2=CH2 (g) + HCl (g)
Sustituyendo los valores de la temperatura en la ecuación de Arrhenius para determinar k, y utilizando ese valor en la ecuación que determina el valor de la concentración de reactivo en función del tiempo, partiendo de una concentraciòn inicial [R]0:
[R] = [R]0 e-kt = [R]0/100
Se obtienen los siguientes resultados de tiempo necesario a cada temperatura:
| T / K | t / s |
|
| 300 | 6,36 1022 |
63400 trillones de años |
| 600 | 1,52 108 |
4,8 años |
| 700 | 105000 | 29,2 horas |
| 800 | 450 | 7,5 minutos |
| 900 | 6,5 | 6,5 segundos |
 , y, por tanto, disminuye k.
, y, por tanto, disminuye k.