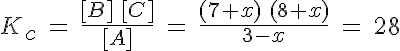5.1 Cambios en las cantidades de sustancia
La forma más habitual de alterar la situación de equilibrio de un sistema es variar la cantidad de sustancia de una o más de las sustancias que intervienen en el equilibrio. Se puede añadir o eliminar tanto reactivos como productos, con lo que su concentración varía.
¿Cómo se justifica la evolución del sistema?
Al cambiar la concentración de alguna de las sustancias, se modifica el cociente de reacción Q, con lo que el sistema ya no está en equilibrio: si se ha añadido reactivos o eliminado productos, Q ha disminuido y es menor que K, por lo que debe aumentar, evolucionando el sistema hacia la derecha. Esto es lo que se hace habitualmente: añadir continuamente reactivos y eliminar los productos para desplazar el equilibrio en el sentido de aumentar el grado de reacción.
A la misma conclusión se llega utilizando el principio de Le Chatelier: si se añade una sustancia, el sistema evoluciona para consumirla en parte, de forma que en el nuevo estado de equilibrio hay más que antes de añadirla, pero menos de lo que cabía esperar (reducción del efecto externo).
 |
Color y concentraciones
El cromato de potasio (K2CrO4) es una sustancia sólida de color amarillo intenso, mientras que el dicromato de potasio (K2Cr2O7) también es un sólido pero de color naranja. Al disolverlas en agua, las disoluciones toman el color proporcionado por los iones CrO42- y Cr2O72- (amarillo y naranja respectivamente).
Vas a deducir cómo están en equilibrio los iones cromato (CrO42-) y dicromato (Cr2O72-), entre ellos y con los iones H+ y OH-. En el guión de trabajo se detalla lo que tienes que hacer y las cuestiones a responder.
La composición en el equilibrio
Un sistema A(g) ↔ B(g) + C(g) se encuentra en equilibrio en un recipiente de un litro cuando las concentraciones respectivas son 2, 7 y 8 moles/L. Si se introduce en el recipiente un mol de A, determina la composición en el nuevo estado de equilibrio.
| |