4. Concepto, escala y medida del pH
Para establecer cuantitativamente la acidez o basicidad de una disolución, en lugar de usar las concentraciones de OH- o H3O+ resulta más cómodo usar su logaritmo cambiado de signo, llamado pOH y pH respectivamente: es más sencillo decir que el pH de una disolución es 4 que decir que su concentración e iones hidronio es 10-4.
| pH = - lg [H3O+] | |
pOH = - lg [OH-] |
El cambio de signo se hace con el fin de que el pH sea un número positivo (aunque no siempre, sí en la mayoría de los casos).
¿Y si se sabe el pH de una disolución y se quiere saber la concentración de iones hidronio? En ese caso hay que hacer la operación inversa, de manera que:
| [H3O+] = 10-pH |
La idea de la escala de pH, esto es, de tomar el logaritmo decimal cambiado de signo, se ha generalizado no solo para expresar la concentración de otros iones, sino también de constantes de equilibrio, sobre todo cuando son pequeñas. Así, por ejemplo, se utiliza con mucha frecuencia la notación: pKa= - log Ka.
 |

|
Hay que señalar que el pH se indica con dos cifras decimales como máximo, ya que la sensibilidad de los métodos experimentales de determinación no permite determinar con precisión la tercera. En las situaciones que debes resolver, con una sola cifra decimal es suficiente.
El pH se mide utilizando medidores de pH (pHmetros), como el que se ve en la imagen. Son aparatos digitales que se introducen en la disolución y directamente dan el valor del pH. El fundamento de su funcionamiento lo verás al estudiar la electroquímica.
La forma más sencilla, pero que proporciona resultados menos precisos, es utilizar papel pH. Se trata de un papel que toma un color distinto y característico según cuál sea la acidez o basicidad de la disolución. Para hacer la medida, simplemente se moja un trozo de papel con la disolución, y pasados unos momentos se compara con la escala de colores que ves en la imagen.
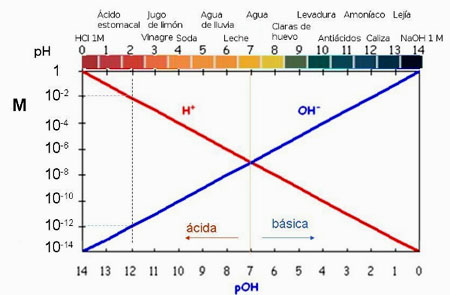
Conviene que tengas presente que, debido al cambio de signo en el logaritmo, la escala de pH va en sentido contrario al de la concentración de iones H3O+: es decir, que el pH de una disolución aumenta a medida que disminuye la [H3O+], o sea, la acidez.
En la imagen de la izquierda puedes hallar la relación entre el pH el pOH y las concentraciones molares de [H3O+] y de [OH-] . Observa que a un pH=2 le corresponde una [H3O+] = 10-2 M, un pOH 12 y una [OH-] = 10-12 M.
Pulsando en la imagen de la derecha ejecutarás una simulación que te va a permitir ver la relación entre el pH y las concentraciones iónicas en diferente sustancias muy habituales.
|
 |
pH y pOH
La suma del pH y el pOH es 14. Se deduce tomando logaritmos y cambiando de signo en la expresión del producto iónico (10-14 = [H3O+] [OH-]).
El pH en disoluciones concentradas
Determina el valor del pH para una disolución en la que [H3O+] = 10 M (por ejemplo, una disolución concentrada de HCl comercial).
Filología y pH
El concepto de pH lo propuso Sörensen en 1909. Era el encargado de los laboratorios de la cerveza danesa Carlsberg, y estudiando los efectos de la acidez en el funcionamiento de las enzimas que hacen fermentar la cerveza vió la necesidad de una medida clara y bien definida de la acidez.
Aunque se han hecho muchas interpretaciones posteriores del significado de la p (potencia de hidrógeno, potencial electroquímico, etc), lo cierto es que Sörensen utilizó las letras p y q en las ecuaciones que panteó al definir el pH, sin darles ningún significado especial, relacionándolo con la concentración de H+, y escribiendo el término como pH, y no Ph, ni ph.
Puedes leer la historia completa en un artículo de Gianni Fochi, publicado en la revista Investigación y Ciencia de septiembre de 2001, páginas 26 y 27.
|
La concentración de H3O+
en la primera es la mitad que en la segunda.
| |
|
La concentración de H3O+
en la primera es el doble que en la segunda.
| |
|
La concentración de H3O+
en la primera es 100 veces mayor que en la segunda. | |
|
Las dos tienen un pH básico.
|
|
Mayor de 14.
| |
|
Mayor de 7.
| |
|
Entre 7 y 14.
| |
|
Menor de 7.
|