11. Aspectos prácticos
 |
Los ácidos y las bases son sustancias de las que se producen millones de toneladas al año en el mundo, dada la enorme diversidad de usos que tienen en química básica como intermedios en la producción de otras muchas sustancias. Al estudiar el estado de equilibrio ya has visto la síntesis del amoniaco por el método de Haber-Bosch. Al desarrollar la electrolisis en la unidad siguiente, verás cómo se obtiene industrialmente el hidróxido de sodio. La reacción química mediante la que se obtiene el ácido sulfúrico la verás al analizar más adelante la formación de la lluvia ácida.
Antes que ver métodos de producción, es más interesante que reconozcas su uso en situaciones muy habituales. Aquí tienes algunas.
El salfumán todavía se utiliza como agente de limpieza en situaciones de suciedad elevada. Se trata de disolución de ácido clorhídrico concentrado, tanto que libera vapores de HCl, muy peligrosos si se respiran directamente.
¿Y los desatascadores de tuberías? Si te has fijado en los que se presentan en estado sólido, se trata de escamas o lentejas blancas, que dejan un tacto jabonoso en contacto con la piel (que debes evitar). Se trata de NaOH, y se utiliza como desatascador por el carácter fuertemente exotérmico de su disolución en agua, que reblandece por calentamiento las masas de materia orgánica que atascan las tuberías.
En la limpieza del cabello se utilizan champús que la propaganda dice que son ácidos, ya que el pelo y la piel tienen un pH ligeramente ácido, de aproximadamente 5, como ves en la imagen. Los jabones caseros que se utilizaban hace muchos años eran muy básicos, alterando el pH natural de piel y cabello, que se volvía quebradizo. Por esa razón, había costumbre de enjuagar el cabello con agua que llevaba vinagre, que suavizaba el pelo y le devolvía a su pH normal. ¡La sabiduría popular tenía una base química!
 |
Disolviendo mármol
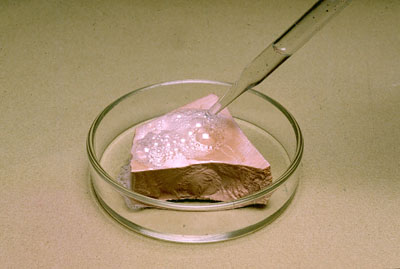 |
Observa la imagen, en la que se ve el ataque del HCl al CaCO3, en el que se disuelve el trozo de mármol y se forman burbujas de CO2. Así que ya sabes: ¡no se te ocurra intentar limpiar con salfumán (disolución de HCl concentrado, que hay que manejar con muchísimo cuidado) una encimera de mármol, cuyo principal componente es CaCO3!
¿Por qué se produce la reacción? Ten en cuenta que el HCl es un ácido fuerte, y que el H2CO3 es un ácido débil.
Por cierto: esta reacción se concretará en el tema siguiente, ya que el carbonato de calcio es una sustancia muy poco soluble en agua, por lo que es necesario plantear el correspondiente equilibrio de solubilidad.
La limpieza de las piscinas
El cloro es un agente desinfectante que se utiliza para mantener el agua limpia en las piscinas. El cloro (Cl2) es un gas, por lo que en las piscinas se suele añadir hipoclorito de sodio, que al disolverse en agua se disocia en NaClO → Na+ + ClO-. El anión hipoclorito procede de un ácido débil y tiene tendencia a reaccionar con el agua, hidrolizándose, ClO- + H2O → HClO + OH-. Como resultado, el agua de la piscina ve incrementado el valor del pH.
|
|
La desinfección se produce cuando el ácido hipocloroso reacciona con la pared bacteriana. Es necesario controlar el valor del pH, para disponer de una concentración efectiva de HClO. El valor del pH de la piscina se debe encontrar entre unos valores de 7 a 7,8, por lo que se debe controlar diariamente.
Recuerda que el pH de la piel es de 5,5, por lo que el agua de la piscina puede resultar agresiva para la piel, pues destruye su capa protectora externa y puede ocasionar problemas de sequedad o irritaciones.
La lejía que utilizas en casa es precisamente una disolución de hipoclorito de sodio. Una de sus propiedades es que es un agente blanqueante de la ropa; en realidad, lo que hace es destruir (oxidar) las moléculas de colorante.
Es muy importante no mezclar la lejía con ácidos, ya que se liberan cloro y ácido hipocloroso, muy reactivos y peligrosos. Si esa mezcla se produce, pasa lo que puedes ver en el vídeo: como dice la protagonista ¡que se lía parda!
 |
Uno de los más utilizados es el NaHCO3 (bicarbonato de sodio), aunque no está recomendado para las personas con hipertensión, ya que una concentración alta de iones sodio tiende a aumentar la tensión arterial. Otro de los problemas del bicarbonato es que modifica rápidamente el pH del estómago y provoca un efecto rebote, de manera que el estómago segrega inmediatamente una cantidad mayor de HCl.
El Alka-Seltzer es un antiácido que, además de bicarbonato, contiene ácido cítrico y aspirina. Este antiácido algunas veces es perjudicial, debido a que la aspirina puede ser dañina para las personas con úlceras y otros desarreglos estomacales.
Neutralizando HCl
Cuando se derrama HCl se puede neutralizar su efecto utilizando bicarbonato de sodio, tal y como sucede en el estómago. Si se neutralizan 50 mL de disolución de HCl con 12 g de bicarbonato ¿de qué concentración es la disolución de ácido?
 |
El pH de la sangre
El pH de la sangre debe mantenerse entre 7,35 y 7,45, ya que la actividad de las enzimas que catalizan la mayor parte de las reacciones que tienen lugar en la sangre solamente actúan dentro de ese intervalo de pH: variaciones de unas décimas por encima o por debajo pueden producir la muerte.
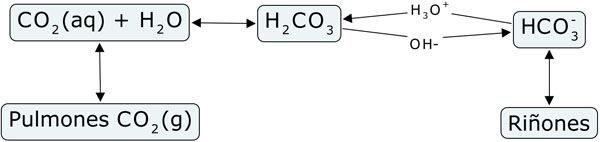
Para conseguir mantener constante el pH, en la sangre hay varios sistemas amortiguadores, siendo el más importante el tampon bicarbonato-ácido carbónico.
El H2CO3 se descompone en CO2 y agua, y el CO2 se puede eliminar de la sangre en los pulmones y expulsarlo al respirar.
Cuando aumenta la cantidad de iones hidronio, el equilibrio se desplaza hacia la izquierda, de forma que el exceso de CO2 se elimina en los pulmones.
Cuando aumenta la cantidad de iones hidróxido, disminuye la de hidronio y el equilibrio se desplaza a la derecha. El exceso de bicarbonato se elimina a través de los riñones.
 |
Ácidos y bases ... en una canción
Tim Blais ha hecho una serie de fantásticos vídeos con contenido científico. La calidad de la producción del vídeo es muy alta, canta bien y es un actor muy divertido. Obviamente, canta en inglés, pero en algunos de ellos, como en este caso, hay subtítulos que facilitan la comprensión de lo que dice (si quieres ver más, entra en Google y busca Tim Blais).