8.1 Radio atómico
¿Pero se puede hablar del radio de los átomos? Ya has visto que no, de acuerdo con el principio de indeterminación: siempre hay una cierta probabilidad de que el último electrón de un átomo se encuentre fuera de la zona límite del 95%, que es la que se representa habitualmente.
Para disponer de una medida del tamaño de los átomos, se hace la suposición de que cuando se unen dos átomos compartiendo electrones (mediante enlace covalente), son dos esferas que quedan superpuestas en parte. Así, cuando se mide la distancia de enlace entre dos átomos de hidrógeno en la molécula de hidrógeno, ese valor es el doble del radio atómico.
El radio atómico se define como la mitad de la distancia entre dos núcleos del elemento unidos por enlace covalente.
En realidad, un átomo libre es más grande que el mismo átomo unido, ya que sus electrones están más "concentrados" en el espacio cuando están unidos a otro átomo. Por ejemplo, el radio atómico del hidrógeno es de 0,30 angstroms, cuando la distancia a la que es más probable que se encuentre el electrón en el átomo de hidrógeno sin enlazar es de 0,53 angstroms.
Utilizando esté método, el radio atómico del H es de 0,30 angstroms y el del Cl de 0,99. Si el método es coherente, la distancia experimental de enlace en el HCl debe ser de 0,30 + 0,99 = 1,29 angstroms: la coincidencia de valores es prácticamente total, ya que el valor experimental es de 1,27 angstroms.
De una forma similar se puede definir el radio de los átomos en los metales, a partir de las distancias entre los átomos en las redes metálicas.
 |
 |
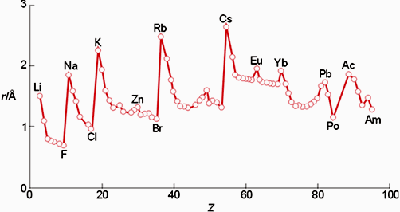
Observa la imagen siguiente. ¿Por qué aumenta la secuencia de radios atómicos de Li, Na, K, Rb y Cs? Todos los elementos alcalinos tienen un electrón en la capa más externa, pero en el litio es la segunda, en el sodio la tercera, en el potasio la cuarta, y así sucesivamente. Como la estructura electrónica es la misma pero en una capa cada vez de mayor tamaño (¡aumenta el número cuántico principal n!), el átomo va siendo cada vez más grande.
¿Y qué sucede en los periodos? Fíjate en que el tamaño disminuye al ir de litio a flúor, y de sodio a cloro, de potasio a bromo, etc. El electrón que diferencia un átomo de otro (berilio de litio, magnesio de sodio, etc) se coloca en la misma capa, y para justificar la disminución experimental de tamaño se supone que aumenta la carga nuclear efectiva, con lo que se produce un efecto de contracción de la nube electrónica.
La atracción de los electrones por el núcleo queda determinada por la carga nuclear efectiva. Su valor depende de los electrones que hay en las capas internas, completas, y en la última capa.
Hay que tener en cuenta que al ir colocándose los electrones en orbitales de la misma capa, quedan más atraídos que si se colocasen en una capa más externa; es decir, aumenta la carga nuclear efectiva.
 |
 |
El tamaño de los gases nobles
¿Por qué no aparecen los gases nobles en las gráficas?
Variación del tamaño de los átomos
Grupos: al bajar en un grupo, la estructura electrónica es la misma pero en una capa más externa, por lo que los electrones están menos atraídos y el tamaño es mayor.
Periodos: al ir hacia la derecha, aumenta la carga nuclear efectiva y el tamaño disminuye.
Comparando el radio atómico de los halógenos
Los radios atómicos de flúor, bromo y yodo medidos en angstroms son, respectivamente:
|
0,64, 1,14 y 1,33. | |
|
1,14, 1,33 y 0,64.
| |
|
1,33, 0,64 y 1,14.
| |
|
0,64, 1,33 y 1,14.
|