8.4 Electronegatividad y carácter metálico
La electronegatividad es un concepto químico más que una propiedad de los elementos aunque, por supuesto, el valor de dicha magnitud depende de su comportamiento químico.
La electronegatividad (EN) mide la mayor o menor atracción -y, por tanto, desplazamiento- que un átomo ejerce sobre el par de electrones de un enlace con otro átomo.
Su valor se determina a partir de una escala. La más utilizada es la de Pauling, en la que, de forma arbitraria, el F tiene EN 4,0 y el Cs 0,7.
Ésta es la propiedad relevante en relación con la capacidad de combinación de los átomos y el tipo de enlace que forman.
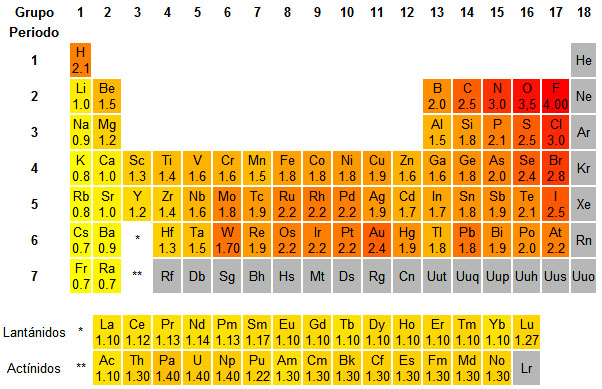
Fíjate en la imagen para deducir cómo evoluciona la EN. El color rojo indica valores altos de la propiedad, y el amarillo valores bajos. El color gris indica que no hay datos: como los gases nobles no forman enlaces, no se puede determinar EN para ellos.
|
Variación de la electronegatividad
La electronegatividad es máxima para los elementos con gran tendencia a captar electrones, situados en la parte derecha de la tabla, y mayor cuanto menor es la capa en la que se encuentran, debido a su cercanía al núcleo. Es mínima en los elementos con tendencia a perder electrones, situados a la izquierda de la tabla, y menor cuanto más grande es la capa en la que están los electrones más externos, ya que la atracción nuclear es menor.
Electronegatividad y elementos químicos
Indica las afirmaciones ciertas:
La electronegatividad de los alcalinotérreos es baja.
| |
Los halógenos tienen EN alta porque tienen pocos electrones en la capa más externa.
| |
Los alcalinos son muy poco electronegativos.
| |
La electronegatividad de los gases nobles es cero.
| |
|
|
Los metales
Son los elementos que tienen tendencia a perder electrones, formando iones positivos. Ese proceso se llama oxidación. Por el contrario, los no metales ganan electrones, reduciéndose.
La mayor parte de los elementos conocidos son metales, y se conocen desde la antigüedad: hierro, cobre, oro, plata, etc.
¿Dónde están los metales en la tabla periódica? En la parte izquierda, mientras que los no metales se encuentran a la derecha. Los gases nobles no tienen carácter metálico o no metálico.
Los elementos son más reactivos cuanto más metálicos o más no metálicos son, ya que entonces tienen más tendencia a transferir electrones, oxidándose en unos casos y reduciéndose en otros.
Fíjate en la violencia de la reacción del litio con agua, formándose hidróxido de litio en disolución y desprendiéndose hidrógeno según indica la ecuación del proceso
2 Li(s) + 2 H2O → 2 LiOH(aq) + H2(g)
Carácter metálico y electronegatividad
Los metales son elementos con electronegatividad baja, mientras que los no metales tienen electronegatividad alta.
La reactividad del sodio y del magnesio
Añade a dos tubos de ensayo unos 5 mL de agua y unas gotas de fenolftaleína. Coloca en uno de ellos un trozo pequeño de sodio y añade al otro un trozo de cinta de magnesio.
a) Observa la diferencia de reactividad y justifícala de acuerdo con sus estructuras electrónicas. ¿Cuál de los dos metales tiene mayor carácter metálico?
b) ¿Por qué se colorea la fenolftaleína? Escribe las reacciones que lo justifiquen.
Semimetales
Hay un conjunto de elementos que tienen electronegatividades intermedias y que presentan características tanto de metales como de no metales. Estos elementos se conocen como semimetales o metaloides (en rojo en la tabla de la imagen).
El más típico es el silicio, que tiene una conductividad de la corriente eléctrica próxima a la de los metales (toda la moderna tecnología electrónica se basa en circuitos integrados de silicio). Aunque no hay un consenso generalizado sobre cuáles son los semimetales, en la imagen puedes ver una de las clasificaciones más habituales.
 |
El grupo del carbono
El grupo 14 es muy especial: tiene un no metal típico como el carbono, los dos semimetales más característicos, silicio y germanio, y dos metales como estaño y plomo. ¿Cómo puedes justificar que en el mismo grupo coexistan los tres tipos de elementos?
Los no metales tienen tendencia a oxidarse.
| |
Si un elemento se reduce con facilidad, es no metálico.
| |
Los no metales se encuentran a la izquierda de la tabla periódica.
| |
Cuanto más abajo se encuentre un elemento en la tabla periódica, menor será su electronegatividad.
| |