8.3 Energía de ionización
La energía de ionización (EI) es la energía que hay que suministrar a un átomo neutro, gaseoso y en estado fundamental para arrancarle el electrón más externo, que está más débilmente retenido, y convertirlo en un catión monopositivo gaseoso.
Se puede expresar así: A(g) + EI → A+(g) + e-
La energía de ionización es igual en valor absoluto a la energía con que el núcleo atómico mantiene unido al electrón: es la energía necesaria para ionizar al átomo.
Al ser la energía de ionización una medida cuantitativa de la energía de unión del electrón en el átomo, la variación de esta magnitud ayuda a comprender las diferencias cualitativas entre estructuras electrónicas.
La magnitud de la energía de ionización depende de tres factores fundamentales: estructura electrónica de la última capa, radio atómico y carga nuclear. El factor determinante es la configuración electrónica de la última capa, puesto que cuanto más estable sea, es decir, cuanto más se parezca a la de estructura completa (estructura de gas noble, con la capa completa), mayor será la energía necesaria para arrancar un electrón.
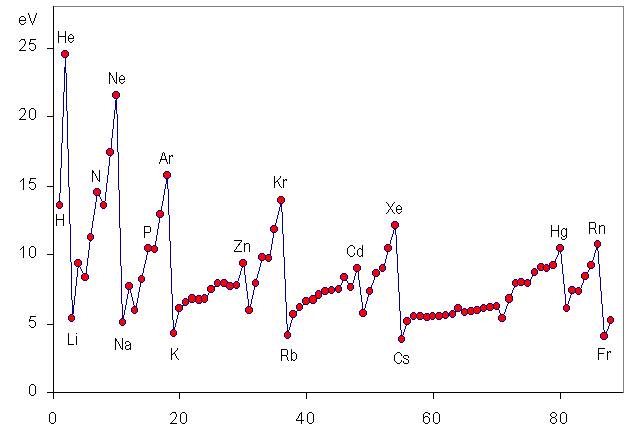
¿Cómo evoluciona esta magnitud en la tabla periódica?
Ya has visto que en los grupos el tamaño de los átomos se hace mayor conforme se baja en la tabla; por tanto, el último electrón está más lejos, y será más fácil arrancarlo.
Sin embargo, el tamaño va disminuyendo conforme se avanza en los periodos, por lo que la energía de ionización debe aumentar.
Otra forma de interpretarlo es considerar que los elementos de la parte izquierda de la tabla tienen pocos electrones en la capa más externa, por lo que será fácil que los pierdan para quedarse con la estructura del gas noble que cierra el periodo anterior: su EI será baja.
Por el contrario, los elementos de la derecha tendrán tendencia a ganar electrones para completar esa capa, adquiriendo la estructura del gas noble que cierra el periodo. Por tanto, su EI será alta.
 |
Energías de ionización sucesivas
Una vez que se ha arrancado un electrón y se ha formado un ión positivo, se puede volver a comunicar energía para arrancar un segundo electrón: es la segunda EI. De forma similar se pueden medir las EI sucesivas tercera, cuarta, quinta, etc. Fíjate en la secuencia de valores para los doce primeros elementos.
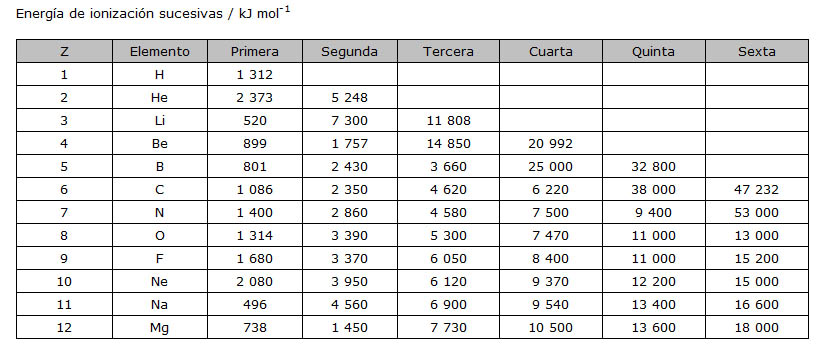
Las EI sucesivas son cada vez mayores, ya que van quedando menos electrones, con lo que aumenta la carga nuclear efectiva. En algunos casos, el aumento es muy significativo: en el litio la segunda es unas 14 veces la primera, mientras que la tercera es vez y media la segunda; en el berilio, la tercera es unas 9 veces la primera, mientras que la segunda y la cuarta son entre 1,5 y 2 veces la anterior. Observa en qué momento se produce ese notable incremento de EI en boro, carbono, nitrógeno, sodio y magnesio.
¿Cómo se interpretan esos resultados experimentales? Son una prueba del número de electrones que tiene cada átomo en la capa más externa: al arrancar un electrón de una capa interior, como es apreciablemente más estable hay que comunicar mucha más energía para conseguirlo.
La energía de ionización en los elementos del segundo periodo
Observa la secuencia de energías de ionización de los elementos del segundo periodo, utilizando tanto la tabla como la gráfica anteriores. Verás que sube de Li (520) a Be (899), baja en el B (801), aumentando en C (1086) y en N (1400); baja otra vez en O (1314), y aumenta en F (1680) y Ne (2080).
Se interpreta como una prueba del principio de máxima multiplicidad de Hund.
Energías de ionización y elementos químicos
Las primeras energías de ionización de tres elementos son 520, 1314 y 2080 kJ/mol. Esos tres elementos pueden ser, respectivamente:
|
O, Ne y Li.
| |
|
Ne, Li y O.
| |
|
Li, Ne y O.
| |
|
Li, O y Ne.
|