1.2 Calor y energía
Definición de calor
Se denomina calor (Q) al proceso de transferencia de energía entre dos sistemas a diferente temperatura sin que se realice ningún trabajo.
 |
Conductividad térmica y sensación de frío o de calor
Al entrar en contacto estos sistemas, se produce un intercambio de energía en forma de calor desde el sistema más caliente hasta el más frío, hasta que las temperaturas se igualan. Esto no quiere decir que en ese momento cese todo intercambio de calor -de hecho están produciéndose continuamente- sino que en promedio la energía intercambiada entre los sistemas es la misma, por lo que no se produce variación en la temperatura.
Cuando un sistema está en equilibrio térmico, todas sus partes tienen la misma temperatura; ahora prueba a tocar con una mano la mesa o un libro que tengas cerca y con la otra cualquier objeto metálico. ¿Cuál de los dos está más caliente?
Ambos están a la misma temperatura, pero entonces ¿por qué parece que el metal está más frío? La respuesta tiene que ver con una propiedad de la materia: la conductividad térmica. No todos los materiales conducen igual de bien el calor; concretamente, los metales conducen muy bien el calor y, por ello, el calor fluye rápidamente de nuestra mano al objeto metálico, y este calor extraído de nuestro cuerpo es lo que nos da la sensación de frío. La madera o el papel son malos conductores, y por ello el calor fluye más lentamente y parecen más calientes.
Pero el calor no se transmite únicamente mediante conducción, sino que existen otros mecanismos que ya conoces: la convección y la radiación.
Unidades de calor
El calor se mide en el S.I. en julios (J), pero también en calorías (cal). Una caloría se define como la energía necesaria para elevar un grado la temperatura de un gramo de agua. La relación entre julio y caloría es 1 cal = 4,18 J.
 |
Calor y cambios de temperatura
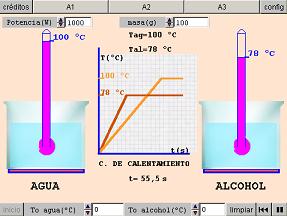
Una experiencia clásica consiste en comunicar la misma cantidad de calor a dos recipientes que contienen igual masa de alcohol y agua.
Fíjate en la gráfica de la imagen: observa que el alcohol aumenta significativamente más rápido su temperatura, hasta que alcanza su temperatura de ebullición (78 ºC), momento en el que cesa de aumentar. Lo mismo sucede con el agua, que se calienta más lentamente y tiene un punto de ebullición más alto.
Por tanto, es necesario introducir una nueva magnitud que exprese el diferente comportamiento de las sustancias al ser calentadas.
Si se transfiere una misma cantidad de calor a dos sistemas distintos, el aumento de temperatura experimentado por cada uno de ellos no es siempre el mismo, sino que depende de su naturaleza y composición. El parámetro que relaciona el incremento de la temperatura con el calor suministrado se denomina calor específico (ce) de una sustancia, definido como la energía necesaria para calentar un kilogramo de una sustancia y elevar su temperatura un Kelvin o un grado Celsius. Es característico de cada sustancia y se mide en el S.I. en J/(kg K).
Ecuación de la calorimetría
La energía transferida a un cuerpo de masa m para que su temperatura pase de una inicial (Ti) a otra final (Tf) viene dada por la expresión:
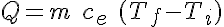
donde ce es el calor específico de la sustancia.
Debido a que aparece una diferencia de temperaturas, se puede utilizar la escala Kelvin o la Celsius, ya que las dos son centígradas.
El calor específico del acero
Cuando se comunican 67500 J en forma de calor a un bloque de acero de 2 kg, se observa que su temperatura aumenta 75 ºC. ¿Cuál es el calor específico del acero?
Aislantes térmicos
Los materiales que se utilizan para aislar edificios, como son las placas de corcho blanco, ¿tienen calores específicos altos o bajos?
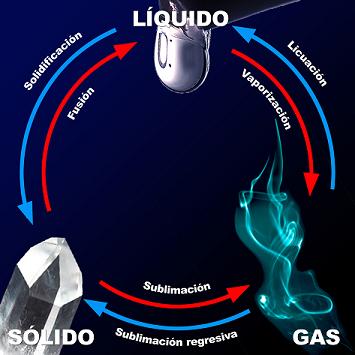 |
Calor y cambios de estado
Aparte del lógico aumento de la temperatura en los cuerpos, cuando se calienta un cuerpo pueden producirse cambios de estado. Al comunicar energía a una sustancia, según la teoría cinética de la materia aumenta la energía cinética de sus partículas, de forma que comienzan a moverse más rápidamente, siendo más probable que adquieran la energía necesaria como para vencer las fuerzas que las mantienen unidas, cambiando su configuración.
Cuando se calienta un sólido, las partículas que se encuentran en posiciones prácticamente fijas comienzan a vibrar con mayor amplitud y velocidad, hasta que se funde. Al alcanzar el punto de energía cinética máxima, la energía adicional se emplea en vencer las fuerzas que mantienen las partículas unidas entre sí, abandonando sus posiciones y pasando al estado líquido.
En este proceso de cambio de estado se produce un intercambio de calor, positivo en el caso de paso de sólido a líquido y negativo pero de igual valor que el anterior en el paso de líquido a sólido, que se utiliza en romper las uniones que mantienen unidas las partículas.
Calor latente de cambio de estado
Se denomina calor latente (L) a la energía intercambiada para producir el cambio de estado de un kilogramo de materia a temperatura constante (temperatura de cambio de estado):
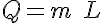
El calor latente se mide en J/kg.
Calentando hielo
Se coloca sobre un plato un cubito de hielo de 50 g que se encuentra inicialmente a una temperatura de -15 ºC. Al cabo de unas horas se observa que se ha transformado en agua que se encuentra a temperatura ambiente (25 ºC). ¿Cuánta energía ha absorbido el hielo del entorno para efectuar esa transformación?
Datos: ce_hielo = 2100 J/(kg K), ce_agua = 4180 J/(kg K), Lfusión = 3,34 105 J/kg