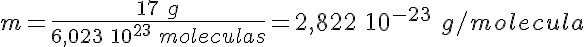2.1 El número de Avogadro
 |
El número de partículas que hay en un mol se llama número de Avogadro, NA, y es 6,023 1023 partículas por mol. ¿Por qué se ha elegido ese valor y no otro más sencillo, como 1020 por ejemplo?
La masa relativa de una partícula indica cuántas veces es mayor su masa que la que se toma como referencia (la doceavaparte de la masa atómica del isótopo 12 del carbono). Es el dato que aparece en la tabla periódica para los átomos, y que se usa para determinar la masa de partículas poliatómicas.
Por ejemplo, mr(H2O)= 18 significa que una molécula de agua tiene una masa 18 veces mayor que la masa unidad. Mientras no se sepa cuál es el valor de esa masa unidad, no hay forma de saber la masa de la molécula de agua, que se indica como 18 u, donde u es la masa real de la unidad de masa atómica.
Pero como la masa unidad es de 1,667 10-24 g, la masa real de la molécula de agua es de 18 1,667 10-24 g. Este número no tiene ninguna utilidad en Química desde el punto de vista práctico, porque no se puede disponer de moléculas de agua aisladas.
Si en un vaso echas el número de Avogadro de moléculas de agua, ¿qué masa de agua tienes? Evidentemente, será la masa molar, es decir, la masa de una molécula multiplicada por el número de moléculas que hay en un mol de sustancia:
18 1,669 10-24 g/molécula 6,023 1023 moléculas/mol = 18 g/mol
Fíjate en que el resultado numérico es 18. Es decir, el número de la masa relativa se mantiene en la masa real y en la masa molar, aunque tiene significados diferentes en los tres casos.
|
mr(H2O)=
18 |
m(H2O)=
18
u |
M(H2O)= 18 g/mol |
¿Por qué el número de Avogadro es 6,023 1023?
Para mantener el mismo número para la masa relativa, la masa real y la masa de un mol (masa molar, M), aunque el significado de las tres magnitudes es diferente.
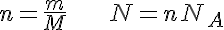 |
n=cantidad de sustancia m=masa de sustancia M=masa molar N=número de partículas NA=número de Avogadro |
Debes tener mucho cuidado a la hora de aplicar estas fórmulas, porque si no tienes las ideas claras, puedes confundirte fácilmente: fíjate en que los símbolos de las magnitudes son letras ene y eme, mayúsculas o minúsculas, y hasta con subíndices.
Es más recomendable utilizar factores de conversión para determinar las magnitudes que necesites. En todo caso, y dado que hay que deberás calcular con mucha frecuencia la cantidad de sustancia sabiendo la masa o al revés, la primera fórmula te puede resultar útil.
Errores terminológicos
Fíjate en las expresiones siguientes, porque son incorrectas:
| 1 mol (O2) = 32 g | |
1 mol (O2) = NA moléculas |
¡Estás igualando magnitudes diferentes: cantidad de sustancia con masa o con número de partículas! Eso sí, te estás refiriendo en todos los casos a la misma cantidad de oxígeno.
Las expresiones siguientes son correctas:
| n (O2) = 1 mol | |
m (O2) = 32 g |
|
N (O2) = NA moléculas |
Un mol y un mol
Además de que es la misma cantidad de sustancia, ¿qué tienen en común un mol de agua y un mol de hierro?
Masa y cantidad de sustancia de agua
Añades a un vaso 90 g de agua. Indica las afirmaciones correctas:
La masa relativa de las moléculas de agua es 18 g/mol.
| |
Hay 10 moles de agua.
| |
Hay 5 NA moléculas de agua.
| |