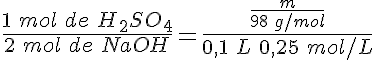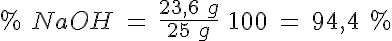10.3 Determinación de concentraciones y purezas
El objetivo de las valoraciones es determinar la concentración de una disolución, que puede llevar además a establecer la pureza de una muestra sólida.
Desde el punto de vista operativo, se trata simplemente de resolver un problema de estequiometría, teniendo en cuenta las cantidades de sustancia de ácido y de base que reaccionan.
El caso más sencillo, y muy frecuente, se da cuando reacciona un mol de ácido con un mol de base, como sucede con HCl y NaOH. Por tanto, n(HCl) = n(NaOH). Las cantidades de sustancia las expresarás como C V (concentración por volumen) si se trata de disoluciones, o como m/M (masa entre masa molar) si se trata de sólidos.
En otros casos, como sucede al reaccionar el H2SO4 o el Ca(OH)2, que producen dos iones H3O+ o dos iones OH-, simplemente deberás tenerlo en cuenta: si la reacción es entre NaOH y H2SO4, la neutralización es:
H2SO4 + 2 NaOH → Na2SO4 + 2 H2O
Por tanto, reaccionan dos moles de hidróxido por cada mol de ácido; es decir, n(NaOH) = 2 n(H2SO4). También puedes utilizar factores de conversión o bien escribir la proporción de combinación constante para resolver el problema estequiométrico:
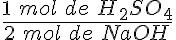
que se lee "1 mol de H2SO4 reacciona con 2 mol de NaOH".
Determinación de concentraciones
Utiliza el simulador para determinar la concentración de las disoluciones. Elige una de ellas y el indicador adecuado en función de la sal que se forma en la neutralización y su posible hidrólisis.
Haz una primera valoración añadiendo de mL en mL para ver por dónde está el punto de neutralización, y repite el proceso añadiendo de golpe el volumen adecuado y después gota a gota hasta el cambio de color del indicador.
Después de leer el volumen de valorante añadido para producir la neutralización, calcula la concentración de la disolución valorada.
 |
Determinación de la composición del vinagre comercial
En la etiqueta indica que es de 5º es decir, del 5% en volumen. Se trata de que determines la cantidad de ácido acético disuelto por litro de disolución y el porcentaje que hay en volumen.
Para ello debes seguir el guión de trabajo adjunto.
Pureza de la sosa caústica comercial
Determina la pureza de una sosa caústica comercial (NaOH impurificada con NaCl), sabiendo que al disolver 25 g de sosa hasta un volumen de disolución de un litro, 20 mL de esa disolución gastan 23,6 mL de HCl 0,5 mol/L.
|
11,37 g
| |
|
10,37 g
| |
|
9,37 g
| |
|
8,37 g
|