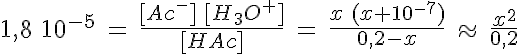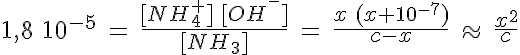6.2 Determinación del pH de disoluciones de ácidos y bases débiles
En las imágenes puedes ver disoluciones de ácido acético, en forma de vinagre comercial, y de amoniaco, como disolución limpiadora, los dos ejemplos típicos de ácido débil y de base débil. ¿Cómo se calcula su pH?
 |
 |
Ácidos débiles
Si la constante de equilibrio Ka es pequeña, el ácido es débil. El ácido HA está parcialmente disociado, y en el equilibrio habrá HA , A- y H3O+, cuyas concentraciones están relacionadas mediante Ka.
Para calcular el valor de las concentraciones en el equilibrio y determinar el pH se hacen dos aproximaciones:
-
Si Ka > Kw se puede despreciar la cantidad de H3O+ aportada por el agua.
-
Si c0 > Ka se puede despreciar la cantidad de ácido disociado debido al pequeño valor de Ka, [HA]eq ≈ c0.
Bases débiles
Si el valor de la constante Kb es pequeño la base es débil. La base B está parcialmente disociada y en el equilibrio habrá B, BH+ y OH-, cuyas concentraciones están relacionadas mediante Kb.
Para determinar el pH se hacen también las mismas aproximaciones que para el caso del ácido débil:
- Si Kb > Kw se puede despreciar la cantidad de OH- aportada por el agua.
- Si c0 > Kb se puede despreciar la cantidad de base disociada debido al pequeño valor de Kb, [B]eq ≈ c0.
Planteamiento de los equilibrios
Tienes que escribir el equilibrio del ácido o de la base, anotar los datos de composición inicial y en el equilibrio y pasarlos a la expresión de la constante de equilibrio para determinar las magnitudes que tengas que calcular.
Resolución de equilibrios ácido-base
Fíjate en que son tres datos o conjuntos de datos (composición inicial, composición en el equilibrio y constante de equilibrio), de los que conociendo dos puedes calcular el tercero.
Ordenando el pH de cinco disoluciones
Ordena el pH de las siguientes disoluciones, todas de la misma concentración: NaOH, HAc, HClO, HCl y NH3. Ten en cuenta que K(NH3) = 1,8 10-5, K(HAc) = 1,8 10-5 y K(HClO) = 3,7 10-8 .