8.1 Potencial de una pila
 |
Con los datos de la tabla de potenciales normales de reducción puede calcularse el voltaje que proporciona una pila formada por cualquier pareja de electrodos, y predecir la polaridad de los mismos. Para ello, no tienes mas que escribir las reacciones del electrodo y sus respectivos potenciales de reducción, con los signos adecuados. El polo negativo será el electrodo de menor potencial, esto es, el más negativo (o menos positivo), que tenderá a ceder electrones; mientras que el polo positivo será el de mayor potencial (más positivo), que tenderá a captar electrones.
El voltaje de la pila será la diferencia de ambos potenciales, y la reacción global de la pila la suma de las correspondientes reacciones.
Fíjate en que solamente debes tener en cuenta que se mantiene el signo del dato del potencial estándar en el proceso en el que se produce la reducción, y se cambia en el caso en el que se produce la oxidación.
En la imagen puedes ver cómo se aplica a la pila Daniell.
Eºpila = Eºmayor - Eºmenor = 0,34 V - (-0,76 V) = 1,10 V
Potencial de una pila
Para calcular el potencial estándar de una pila, al potencial estándar mayor (reducción en el cátodo) se le quita el potencial estándar menor (oxidación en el ánodo), calculándose así la diferencia entre ambos valores, la diferencia de potencial.
Espontaneidad de las reacciones redox
Cuanto más tendencia a producirse tenga una reacción redox, ya que la diferencia de potenciales de reducción es mayor y más positivo es el potencial de la pila que se puede construir, más espontánea es y más negativa es la entalpía libre de reacción ΔG.
Hay una relación directa entre el potencial de pila y la entalpía libre de reacción: ΔGº = - nFEº
donde n es el número de electrones intercambiados en la reacción ajustada de la pila, F es el Faraday (96540 culombios) y Eº el potencial normal de la pila.
Además, hay que tener en cuenta que el potencial de la pila depende de las concentraciones iónicas en disolución. La ecuación de Nernst relaciona el potencial de una pila en condiciones estándar (Eº) con el potencial si las concentraciones son diferentes (E):
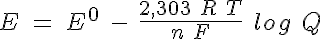
donde Q es el cociente de reacción.
¿Por qué se agotan las pilas?
Conforme se va produciendo la reacción de la pila, va disminuyendo la cantidad de reactivos y aumentando la de productos, con lo que el cociente de reacción aumenta y, de acuerdo con la ecuación de Nernst, el potencial de la pila E disminuye.
En consecuencia, las pilas van dando un voltaje menor a medida que se van utilizando, su espontaneidad va siendo menor (al disminuir E, aumenta ΔG) y la pila se agota.
Con un electrodo de Zn2+/Zn y otro de Cd2+/Cd no se puede construir una pila, ya que ambos tienen potenciales de reducción estándar negativos y hace falta que uno sea positivo.
| |
Si en una disolución que contiene iones Cu2+ se introduce una lámina de cinc, sobre ella se depositará cobre metálico
| |
Si a una disolución que contiene iones Cd2+ se añaden iones Cu2+, se depositará cobre metálico
| |
¿Qué pila se puede construir?
Los potenciales de reducción estándar de los electrodos Sn2+/Sn y Ag+/Ag son, respectivamente, Eº (Sn2+/Sn) = -0,14 V y Eº (Ag+/Ag) = 0,80 V. Si montas una pila utilizando láminas de ambos metales y disoluciones 1 M de sus iones:
a) ¿Qué reacciones se producen en los electrodos de esta pila?
b) Identifica el ánodo y el cátodo de la pila.
c) ¿Cuál es el potencial estándar de la pila formada con estos dos electrodos?
Calculando el potencial de pila
Teniendo en cuenta que Eº (Fe2+/Fe) = -0,44 V y Eº (Ag+/Ag) = 0,80 V, el potencial de la pila en la que se produce espontáneamente la reacción Fe(s) + Ag+(aq) → Fe2+(aq) + Ag(s) es:
|
-0,80 V
| |
|
1,24 V
| |
|
0,36 V
| |
|
-1,24 V
|
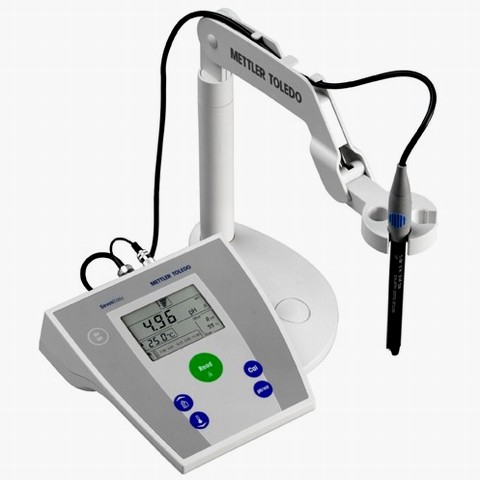 |
Medida de concentraciones iónicas
El potencial de los electrodos depende de las concentraciones iónicas en disolución. De esta forma, el potencial de un electrodo de cobre es 0,34 voltios si la [Cu2+]= 1 mol/L, pero diferente en el resto de casos.
La ecuación de Nernst relaciona el potencial de una pila en condiciones estándar (Eº) con el potencial si las concentraciones son diferentes (E):
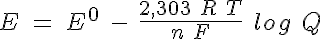
donde Q es el cociente de reacción.
Por ejemplo, en la pila Daniell Zn(s) + Cu2+(aq) ↔ Zn2+(aq) + Cu(s), se cumple que:

Por tanto, si se sabe la [Cu2+] y se mide el potencial de la pila, se puede determinar la [Zn2+].
Este hecho permite disponer de electrodos selectivos, cuyo potencial depende de la concentración de un ión concreto. Si es sensible a la concentración de los iones hidrógeno y la escala de medida es logarítmica, se tiene un medidor de pH, un pHmetro, como el que tienes en la imagen.