4.1 Números cuánticos y orbitales
Los orbitales se nombran indicando el valor de n y una letra dependiendo del valor de l (s si l=0; p si l=1; d si l=2 y f si l=3). En la tabla adjunta se detallan los nombres de todos los orbitales posibles hasta n=4. En el caso de los orbitales p, se indica con un subíndice la orientación, x, y ó z (no es necesario que sepas los nombres exactos de los orbitales d ó f).
| |
Características físicas de los orbitales
Las características de los orbitales en los que se encuentran los últimos electrones determinan las propiedades de los átomos y, en definitiva, de las sustancias: reactividad, tipo de enlace, geometría molecular, etc. Por esa razón, es muy importante que compares y diferencies las características físicas de los orbitales, de acuerdo con la tabla anterior. Ten en cuenta que el "tamaño" de un orbital debes entenderlo como el volumen de la superficie límite dentro de la cual hay una probabilidad determinada de encontrar al electrón que se encuentra en ese estado.
En la imagen siguiente puedes ver los diferentes tipos de orbitales para n=4: un orbital s, tres orbitales p, cinco orbitales d y siete orbitales f. Solamente tienes que saber la forma de los orbitales s y de los orbitales p.
Los tres orbitales p con igual n tienen la misma energía, y se dice que están degenerados. Lo mismo sucede con los cinco orbitales d y los siete orbitales f.
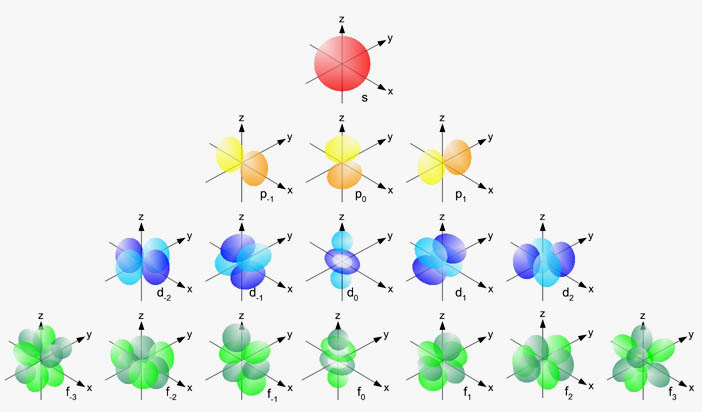 |
Fíjate ahora en las imágenes que se pueden obtener de los orbitales mediante simulaciones informáticas, y la relación que hay entre experiencias ondulatorias y las formas de los orbitales.
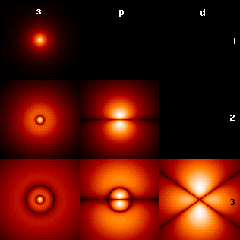 |
|
Comparando orbitales (I)
Indica en qué características físicas se parecen y en cuáles se diferencian los orbitales:
a) 2s y 3px
b) 3py y 4pz
