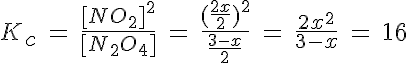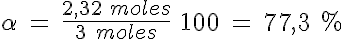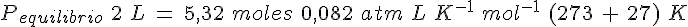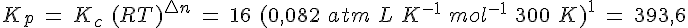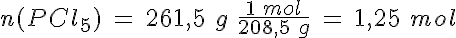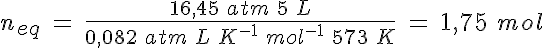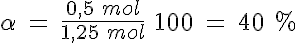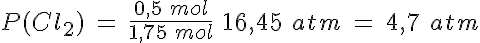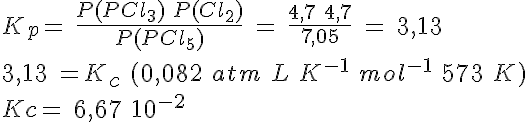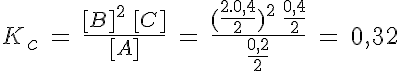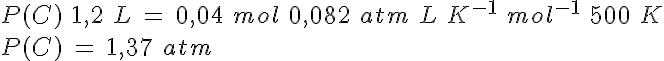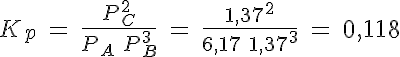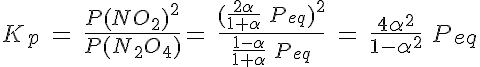3. La composición en el equilibrio
Cuando dispones de la composición de un sistema ¿cómo puedes saber su composición una vez alcanzado el equilibrio? Y al revés, dada la composición en equilibrio, tienes que saber determinar la constante de equilibrio.
El planteamiento y la técnica a utilizar es sencilla, pero la resolución resulta a veces un poco compleja, sobre todo en los sistemas gaseosos. Verás cómo en los sistemas en disolución la parte operativa es notablemente más sencilla, porque ahora vas a tener que trabajar con concentraciones o con presiones, y con sus constantes respectivas, aplicando la ecuación de los gases cuando lo necesites, mientras que en las disoluciones solamente se trabaja con Kc.
Resulta más sencillo que plantees la composición inicial y en el equilibrio utilizando la cantidad de sustancia, porque así puedes pasar fácilmente a concentraciones (dividiendo por el volumen) o a presiones (con la ecuación de los gases). Además, también calcularás fácilmente el grado de reacción (la cantidad que ha reaccionado en relación con la que podía reaccionar).
Para comenzar, un caso típico que marcará la pauta sobre cómo debes plantear el equilibrio en la mezcla reaccionante. En primer lugar, plantea el problema utilizando el parámetro intermedio x para resolver la situación de equilibrio, con lo que verás que el grado de reacción se calcula de una forma muy sencilla: siendo x la cantidad de sustancia que reacciona y ninicial la que había en total para reaccionar, el grado de reacción es:
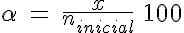
El equilibrio de disociación del N2O4
Se introducen 3 moles de gas N2O4 en un recipiente de 2 litros a 27ºC y se deja que se establezca el equilibrio de disociación en gas NO2. Si la Kc es de 16, determina:
a) la composición de la mezcla en equilibrio.
b) el grado de disociación.
c) la presión en el equilibrio.
d) el valor de Kp.
e) Justifica sin realizar cálculos si la presión de equilibrio será mayor, menor o igual a la inicial.
Mezclas de gases
En este tema y en el siguiente los cálculos se van a centrar en equilibrios entre gases. Por tanto, vas a trabajar con presiones y con Kp en lugar de con concentraciones y Kc.

|
Como va a haber una mezcla de gases, en equilibrio o no, conviene que utilices la presión parcial de cada uno de ellos. Cuando tiene nA moles de un gas A en un recipiente de volumen V a temperatura T, produce una presión PA, que puedes calcular a partir de la ecuación de los gases (izquierda). Si introduces nB moles de otro gas B en un recipiente de igual volumen y a la misma temperatura, la presión será PB (centro). Como la presión depende de la cantidad de sustancia de gas y no de su tipo (principio de Avogadro), si hay el doble de gas de B que de A, la presión que generará también será doble: la presión es proporcional a la cantidad de sustancia.
Pero ¿qué sucede cuando en un tercer recipiente, en las mismas condiciones de V y T que antes, se introducen los dos gases a la vez? Si piensas un poco, te darás cuenta de que como la cantidad total de sustancia es nA + nB, la presión total será PA + PB (derecha). A esos valores de presión en la mezcla se les llama presiones parciales de cada uno de los gases, y es la presión que cada uno de ellos produciría si estuviese sólo en el recipiente. Se trata de una situación hipotética, ya que en realidad los gases están mezclados.
Como acabas de ver, la presión total es la suma de las presiones parciales. Puedes trabajar calculando cada una de ellas mediante la ecuación de los gases, o bien utilizar la relación entre la presión parcial y las fracciones molares (fracción de moles de cada gas en la mezcla).
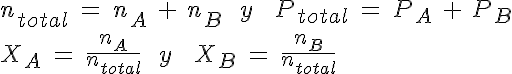
Teniendo en cuenta la relación de proporcionalidad entre cantidad de sustancia y presión (principio de Avogadro), puedes escribir:
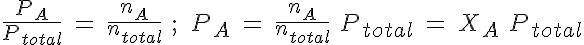
En general, la presión parcial de un gas es su fracción molar por la presión total. Sin embargo, es más sencillo utilizar la proporcionalidad entre cantidad de sustancia y presión, y así no hay que recordar una fórmula más.
La disociación del PCl5
En un recipiente de 5 litros mantenido a 300ºC en el que previamente se ha hecho el vacío, se introducen 261,5 g de PCl5(g) y se cierra, estabilizándose la presión cuando alcanza un valor de 16,45 atmósferas al establecerse el equilibrio PCl5(g) ↔ PCl3(g) + Cl2(g).
Calcula el grado de disociación, las presiones parciales de los gases y los valores de Kp y Kc.
Planteamiento con el grado de disociación
Hay un caso particular en el que los datos son el grado de disociación y la presión en el equilibrio, y no se sabe ni la composición inicial ni la constante de equilibrio. Fíjate en que la forma de resolverlo es hacer el planteamiento con el grado de disociación en lugar de con la cantidad de sustancia que reacciona.