6. La síntesis del amoniaco
La síntesis del amoniaco es uno de los equilibrios más estudiados, y precisamente vas a aplicar lo que has aprendido hasta ahora con objeto de establecer las mejores condiciones para obtener esa sustancia.
A temperatura ambiente, el amoniaco es un gas incoloro de olor muy penetrante. Es muy soluble en agua, por lo que habitualmente se usa en disolución. Más del 80% del amoniaco que se produce industrialmente se utiliza en la fabricación de abonos (sales amónicas), y el resto tiene usos muy diversos, desde fabricación de explosivos a tintes, lacas o limpiadores amoniacales.
El NH3 se obtiene por el método denominado proceso Haber-Bosch (por su puesta en marcha Fritz Haber y Carl Bosch recibieron el Premio Nobel de Química en los años 1918 y 1931), que consiste en la reacción directa entre el nitrógeno y el hidrógeno gaseosos.
Condiciones para la síntesis del amoniaco (I)
Fíjate en el simulador siguiente. ¿Cómo se modifican las cantidades de cada una de las tres sustancias al aumentar o disminuir la presión? ¿Y al calentar o enfriar? En consecuencia, ¿cómo deben ser las presiones y temperaturas de trabajo en la síntesis del amoniaco?
|
|
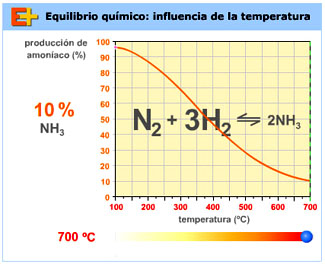
Como la síntesis de Haber-Bosch es exotérmica, conviene trabajar a temperaturas bajas para que el grado de reacción sea alto. Sin embargo, es una reacción lenta, puesto que tiene una energía de activación grande. Por esa razón, no conviene trabajar a temperaturas demasiado bajas, porque entonces la reacción es excesivamente lenta. Para conseguir que el equilibrio se alcance en un tiempo razonable, la temperatura de trabajo es media, del orden de 450 ºC, y se utiliza un catalizador (Fe, K2O, Al2O3) para disminuir la barrera de energía.
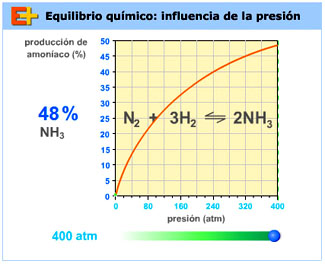
En cuanto a la presión, es alta, del orden de 500-600 atmósferas, ya que así, de acuerdo con el principio de Le Chatelier, el equilibrio se desplaza hacia la formación de amoniaco, con disminución de la cantidad de sustancia y de la presión.
El nitrógeno y el hidrógeno se inyectan continuamente en el reactor para favorecer la formación de amoniaco. Además, aprovechando la solubilidad del amoniaco en agua, se va eliminando de la mezcla gaseosa al disolverlo en una lluvia de agua pulverizada, con lo que el equilibrio se desplaza para producir más amoniaco. Esta forma de trabajar se denomina en régimen continuo.
Con estas condiciones se consigue un grado de conversión del 50% en un tiempo razonablemente corto: se ha conseguido optimizar el proceso y que la producción de amoniaco sea máxima en un tiempo determinado. Además, el nitrógeno y el hidrógeno que no se han convertido en amoniaco se reciclan, volviéndose a inyectar en el reactor.
 |
 |
|
No pueden ser datos ciertos, ya que, en este caso, el grado de reacción no depende de la presión.
| |
|
A 1000 atm el grado de reacción es del 71 %.
| |
|
El grado de reacción del 52 % se ha medido a 1000 atm.
| |
|
El grado de reacción del 71 % se ha medido a 300 atm.
|
Optimizando la síntesis del amoniaco
Utilizando el simulador siguiente, determina las condiciones más adecuadas para tener un grado de conversión lo más cercano posible al 50%. Fija la temperatura y la presión con las barras deslizadoras, inicia el proceso y descarga el reactor cuando se alcance el equilibrio: verás la producción total (el grado de conversión en amoniaco).
Debes procurar que la temperatura y la presión sean lo más cercanas posible a las condiciones ambientales, ya que así la instalación y su mantenimiento serán más económicos y el producto obtenido más competitivo.