5. Alterando el estado de equilibrio
Una vez que un sistema ha alcanzado el estado de equilibrio (Q = K), su composición ya no cambia mientras no haya influencias externas al sistema. Se comprueba experimentalmente que hay diferentes formas de alterar la situación de equilibrio de un sistema mediante acciones externas:
- añadiendo o quitando sustancias que intervienen en el equilibrio (cambios en las cantidades de sustancia).
- cambiando el volumen del recipiente que contiene al sistema (cambios de presión por variación de volumen, ya que la presión también se modifica por cambios de cantidad de sustancia o de temperatura).
- calentando o enfriando (cambios de temperatura).
Naturalmente, el sistema deja de estar en equilibrio (Q ≠ K), por lo que debe evolucionar para alcanzar un nuevo estado de equilibrio. ¿Cómo lo hace para llegar a esa situación?
| no(H2) |
no(I2) | no(HI) | neq(H2) | neq(I2) | neq(HI) | Kc |
|
| 8 |
5 |
2 |
|
|
|
|
|
| Experiencia 1 | |
|
|
|
|||
| Experiencia 2 | |
|
|
|
|||
| Experiencia 3 | |||||||
| Experiencia 4 |
|||||||
| Experiencia 5 | |||||||
| Experiencia 6 |
En 1884 Le Chatelier, atendiendo a observaciones puramente experimentales que no tenían ninguna justificación teórica pero que permitían hacer predicciones correctas, estableció el principio que lleva su nombre. Actualmente se sigue utilizando el principio de Le Chatelier, pero, como vas a ver, no es la única forma de explicar lo que sucede, y, además, las predicciones que hace son incorrectas en algunos casos.
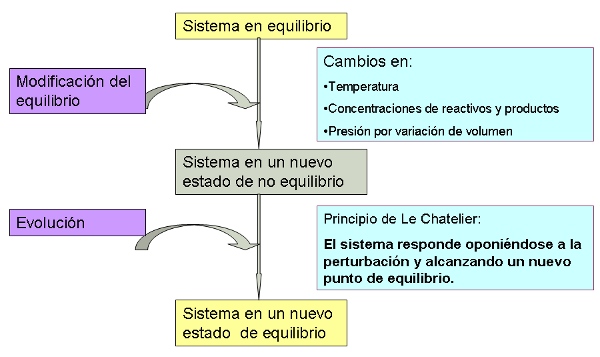 |
De una forma simplificada, se puede decir que:
Cuando sobre un sistema en equilibrio se realiza una acción externa que lo perturba rompiendo el estado de equilibrio, el sistema evoluciona para alcanzar un nuevo estado de equilibrio, oponiéndose a la acción externa para que la perturbación sea menor de la esperada.
Es decir, si hay n moles de una sustancia A que está en equilibrio y se añaden x moles, se rompe el estado de equilibrio y se alcanza uno nuevo, en el que de la sustancia A hay una cantidad menor de n+x (¡pero mayor que n!), que era la cantidad esperada: se reduce el efecto de la perturbación exterior.
Para explicar situaciones concretas, podrás hacer uso del principio de Le Chatelier, o bien compararás el cociente de reacción con la constante de equilibrio.
El efecto de los catalizadores
Los catalizadores cambian las energías de activación directa e inversa, pero no cambian la entalpía libre de reacción y, por tanto, tampoco cambian la constante de equilibrio. Puesto que tampoco alteran el cociente de reacción, no influyen en la condición de equilibrio y no tienen ningún efecto sobre él: lo único que provocan es que el equilibrio se alcance antes.