2. Enlace iónico
|
|
Fíjate en la reacción entre cloro y sodio para formar cloruro de sodio. A partir de un gas y de un metal se forma una sustancia cuyas propiedades indican que se trata de una sustancia iónica, y que no tienen nada que ver con las propiedades de las sustancias que la han originado (molecular y metálica, respectivamente).
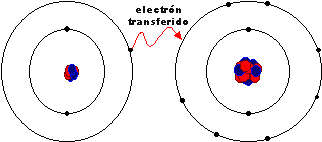
Las sustancias iónicas se forman al transferirse electrones de un metal, que produce iones positivos, a un no metal, que da lugar a iones negativos. La cantidad de electrones intercambiados depende del número de electrones que sobran o faltan para completar la capa más externa en cada átomo.
Formación de estructuras gigantes
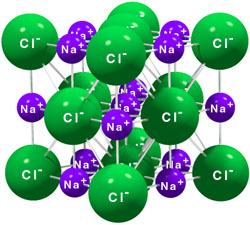
Es importante que tengas en cuenta que no se forma un solo ión de cada tipo. Observa la animación, en la que verás que el único electrón de la capa más externa de un átomo de sodio pasa a completar la última capa de un átomo de cloro, con lo que los dos cumplen la regla del octete. Como puedes ver, se forma una gran cantidad de iones de ambos tipos, que interaccionan eléctricamente entre ellos, atrayéndose los de carga de distinto signo y repeliéndose los de carga del mismo signo. Todos esos iones se ordenan regularmente en una estructura gigante o cristal de forma cúbica, de manera que cuantos más iones se formen, porque se pone a reaccionar más cloro y más sodio, mayor será el cristal.
El tipo de ordenación de los iones se reproduce a escala macroscópica: observa los cristales de la imagen de la derecha, que tienen formas diferentes según sea la ordenación de los iones a escala microscópica.
|
|
 |
 |
 |
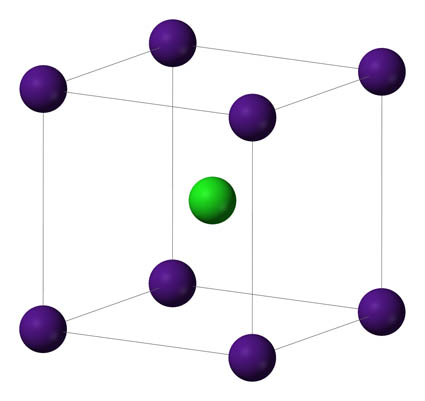 |
Se trata de una red cúbica centrada en el espacio, pero hay otras redes cúbicas, centradas en las caras como sucede en la red del NaCl, o redes hexagonales o con otras estructuras geométricas más complejas.
La forma en que se disponen los iones constituyentes de una red cristalina iónica depende de:
- La proporción de aniones y cationes, ya que la carga eléctrica en el conjunto de la red debe ser nula.
- El tamaño relativo de los iones (alrededor de un ión positivo grande se pueden distribuir más iones negativos pequeños que iones negativos grandes).
Identificando el metal
La fórmula de una sustancia iónica es MS, donde M indica el símbolo de un metal, mientras que S indica azufre. ¿De qué metal puede tratarse?
|
Calcio
| |
|
Litio
| |
|
Aluminio
| |
|
Carbono
|