7. Polaridad de los enlaces y de las moléculas
Cuando los dos átomos unidos mediante enlace covalente tienen electronegatividad diferente, la nube electrónica está más cerca del más electronegativo. El enlace se llama polar, y es un tipo particular de enlace covalente.
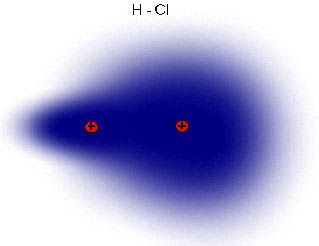
Observa en la imagen lo que sucede con el cloro y el hidrógeno: los electrones están más cerca del cloro, más electronegativo, que del hidrógeno. También se suele indicar una cierta densidad de carga negativa sobre el cloro y positiva sobre el hidrógeno, donde δ (delta) es menor que la unidad, ya que en ese caso se habrían formado dos iones.
Esta distribución de dos cargas de la misma magnitud y signo contrario se llama dipolo, y su efecto se mide por el momento dipolar, magnitud vectorial cuyo módulo es el valor de las cargas por la distancia que las separa. Al tratarse de una magnitud vectorial, se representa por un vector orientado hacia el elemento más electronegativo del dipolo (H→Cl).
|
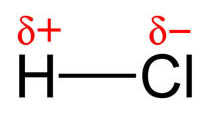 |
|
Los átomos de oxígeno tienen electronegatividad alta.
| |
|
Los dos átomos de la molécula son iguales.
| |
|
En la molécula hay solamente átomos de no metal.
| |
|
Debe haber más de dos átomos para que la molécula sea polar.
|
Polaridad de los enlaces y polaridad molecular
Cuando la molécula es diatómica, la situación es muy sencilla: si los átomos tienen la misma electronegatividad, el enlace y la molécula son apolares, y si son diferentes, polares. Por ejemplo, son los casos de Cl2 y de HCl.
Si hay dos enlaces entre tres átomos, puede darse el caso de que teniendo enlaces polares la molécula sea polar, como es el caso del agua, o apolar, como sucede en el dióxido de carbono. ¿A qué se debe?
Si una molécula tiene varios enlaces polares, pueden compensarse sus separaciones de cargas (sus momentos dipolares de enlace), según sea la geometría de la molécula. Fíjate en el caso del CO2, que es una sustancia apolar, a pesar de que los enlaces entre el carbono y el oxígeno son polares, ya que el oxígeno es apreciablemente más electronegativo que el carbono, y los electrones de enlace están desplazados hacia él. La causa de que la molécula sea apolar es que su geometría es lineal, con lo que los dos vectores momento dipolar de enlace son de igual módulo y dirección pero de sentidos contrarios.
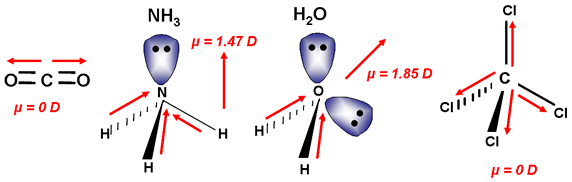 |
Por el contrario, como el agua es angular, los dos momentos dipolares de enlace no se anulan, y la molécula es polar (se representa el momento dipolar resultante).
Si hay más de dos enlaces, el análisis es similar: el NH3 es polar debido a su geometría de pirámide trigonal, mientras que el BF3 es apolar, por ser triangular plana (la resultante de tres vectores de igual módulo que forman un ángulo de 120º es nula).
El CCl4 es apolar por la misma razón: la resultante de los cuatro vectores momento dipolar de enlace es nula si su geometría es tetraédrica.
En la tabla siguiente puedes ver los casos que se plantean en casos muy conocidos de moléculas del tipo AB2, AB3 y AB4, que tienen dos, tres o cuatro enlaces polares iguales.
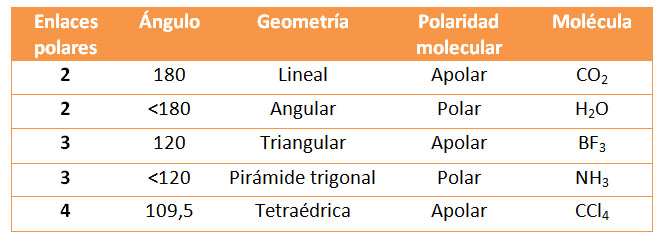
Enlaces polares y moléculas polares
Para que una molécula sea polar, es necesario que tenga enlaces polares y que además no se compensen los momentos dipolares de esos enlaces. Dependiendo de la geometría molecular, una molécula con enlaces polares es polar o apolar.
Polaridad y geometría (I)
Las moléculas de ácido sulfhídrico (H2S) y fosfina (PH3) son polares. ¿Qué puedes deducir acerca de su geometría?
Polaridad y geometría (II)
El NH3 y el BF3 tienen la misma estequiometría (un átomo de un tipo y tres de otro), pero como el NH3 es polar mientras que el BF3 es apolar, su geometría deber ser diferente: el NH3 tiene una estructura piramidal, con ángulos de enlace algo menores de 109,5º, mientras que el BF3 la tiene triangular plana, con ángulos de enlace de 120º. Justifica esa diferencia utilizando el modelo de enlace de valencia.