4. Enlace covalente
Como ya has visto, hay dos tipos de sustancia en las que el enlace es covalente: las sustancias moleculares, que se llaman también sustancias covalentes moleculares haciendo referencia a que el enlace es covalente y las partículas existentes son moléculas, mientras que las sustancias covalentes también reciben el nombre de atómicas, covalentes reticulares o de red covalente atómica, indicando que el enlace es covalente y que se forman redes tridimensionales, estructuras gigantes.
El criterio adoptado aquí, por simplicidad, es llamarlas sustancias moleculares y sustancias covalentes, respectivamente.
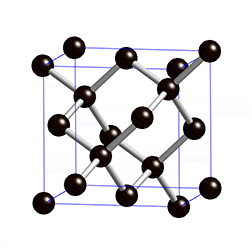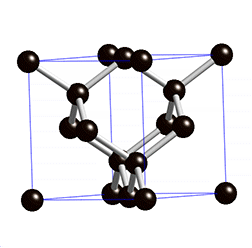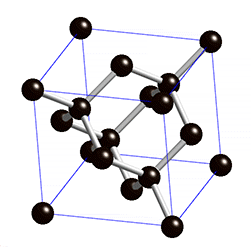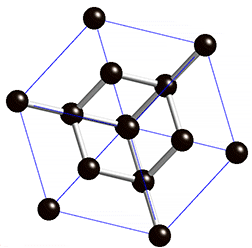 |
Fíjate en las imágenes. La molécula de metano tiene una estructura tetraédrica, en la que un átomo de carbono está unido a cuatro de hidrógeno, de forma que el ángulo de enlace es de 109.5º en todos los casos, como se ve en el modelo de bolas y varillas (y algo peor en el modelo de casquetes de la derecha).
El diamante, sin embargo, forma una estructura gigante, en la que cada átomo de carbono está unido a otros cuatro dando lugar a una distribución también tetraédrica, pero en la que no hay mas que átomos de carbono. El tamaño del cristal de diamante será mayor cuantos más átomos de carbono haya.
¿Qué tienen en común ambas sustancias? Que el enlace es covalente, aunque en un caso se formen moléculas y en el otro estructuras gigantes.
Modelos de enlace covalente
Para explicar el enlace covalente en ambos tipos de sustancias vas a utilizar dos modelos. El primero (estructuras electrónicas de Lewis) se basa en la compartición de electrones de la capa de valencia, y ya lo has aplicado en cursos anteriores. Ahora lo completarás con el modelo de repulsión de pares de electrones de la capa de valencia (RPECV) que parte de la estructuras de Lewis para determinar la geometría de la molécula o de la estructura gigante.
Después verás el modelo de enlace de valencia, en el que el enlace se basa en la superposición de orbitales atómicos de dos átomos, cada uno de ellos con un electrón.
El carbono y el silicio
Sólo forman redes covalentes los elementos del grupo 14 carbono y silicio. Son los únicos que forman cuatro enlaces: los elementos con tres enlaces no pueden formar redes, ya que tres puntos siempre determinan un plano.
En el caso del silicio se forman los silicatos, que son el grupo de minerales de mayor abundancia, pues constituyen más del 95% de la corteza de la Tierra, formando rocas. Además de silicio, están formados por oxígeno y algunos metales como aluminio o hierro.
Además de formar estructuras gigantes, el carbono da lugar a cadenas carbonadas, en las que se une fundamentalmente a hidrógeno dando lugar a hidrocarburos y al resto de compuestos del carbono, comúnmente conocidos como compuestos orgánicos y que son la base de la materia viva.