6. Hibridación de orbitales
La estructura del átomo de carbono es C: 1s2 2s2 2px 2py. Como no tiene mas que dos electrones desapareados, solamente podrá formar dos enlaces según la teoría de enlace de valencia. ¡Pero es que en los millones de compuestos de carbono que se conocen, -con excepción del CO- forma cuatro enlaces!
|
¿Qué necesita el átomo de carbono para formar cuatro enlaces? Nada más que tener cuatro electrones desapareados. La forma más sencilla de lograrlo es hacer que un electrón del orbital 2s pase al orbital vacío 2pz. Es decir, se alcanza un estado excitado del carbono, ya que pasa un electrón de un estado de menor energía (orbital 2s) a otro de mayor energía (orbital 2pz). Sin embargo, por el hecho de producirse esta promoción electrónica el carbono forma cuatro enlaces en lugar de dos, y como al formar enlaces se desprende energía, en conjunto el balance energético es favorable (debe serlo, ya que al formarse compuestos del carbono a partir de sus elementos se observa desprendimiento de energía).
Si utilizase los cuatro orbitales anteriores para formar enlaces al superponerse con los orbitales 1s de cuatro átomos de hidrógeno, habría tres enlaces iguales, originados por los tres orbitales p, y uno diferente, producido por el orbital s.
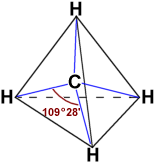
Pero si te fijas en la estructura de la molécula de metano, verás que tiene cuatro enlaces C-H exactamente iguales, dirigidos hacia los vértices de un tetraedro formando un ángulo de unos 109.5º.
Es decir, con los argumentos que tienes hasta ahora, no es posible explicar correctamente las características experimentales del enlace en esta molécula.
Hay casos como BeCl2 y BF3 en los que como en el CH4 tampoco se puede explicar la existencia de la molécula, mientras que en casos como el H2O y el NH3 lo que no es posible justificar correctamente es el ángulo de enlace.
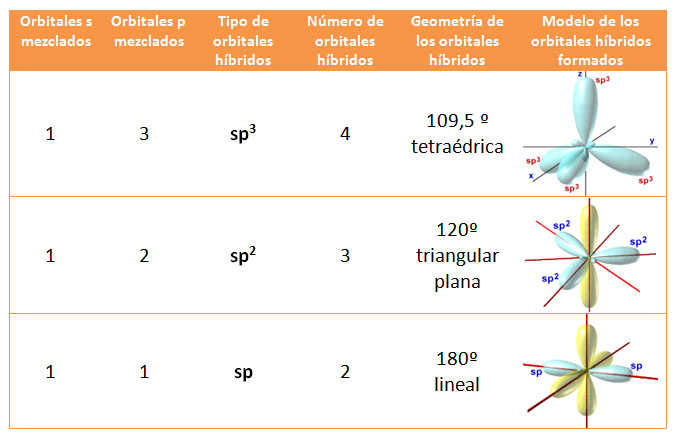
Para explicar esa situación experimental, se recurre a un proceso mediante el cual los orbitales s y p se combinan entre sí, obteniéndose orbitales atómicos con características intermedias (orbitales híbridos). Como son más direccionales que los orbitales s y p, forman enlaces más fuertes y las sustancias resultantes, moleculares o covalentes, son más estables.
El número de orbitales híbridos que se forman siempre es igual al número de orbitales atómicos del que se parte. Todos los orbitales híbridos formados son "equivalentes" y están "preparados" para un mayor solapamiento que da lugar a enlaces más fuertes y estructuras más estables.
|
Valencias múltiples
La promoción electrónica permite explicar en algunos casos sencillos las valencias múltiples que tienen bastantes átomos. Por ejemplo, ¿por qué el azufre tiene valencias covalentes II, IV y VI mientras que el oxígeno solamente tiene valencia II?
La estructura electrónica del azufre es S: 1s2 2s2 2p6 3s2 3px2 3py 3pz. Por tanto, según el modelo de enlace de valencia, el azufre formará dos enlaces, ya que tiene dos electrones desapareados. Esto es lo que sucede en el H2S.
Pero en el SO2 el azufre forma cuatro enlaces covalentes (en realidad, son dos enlaces dobles con dos átomos de oxígeno). Para conseguirlo, se produce la promoción electrónica desde el orbital 3p al 4s, que es el más cercano en energía, alcanzándose la estructura electrónica S*: 1s2 2s2 2p6 3s2 3px 3py 3pz 4s. Aunque haga falta energía para alcanzar ese estado excitado, se desprende mucha más energía al formarse cuatro enlaces en lugar de dos, y se compensa la aportación inicial.
Si se produce una segunda promoción electrónica, quedan seis electrones desapareados, y la valencia del azufre es VI, como sucede en el SO3 y en el H2SO4.
En el caso del oxígeno no se puede producir la promoción electrónica,