Física y química 3º de ESO Tema 3. Reacciones químicas
 |
Cuando se funde el hielo, el agua en estado sólido pasa a encontrarse en estado líquido, pero sigue siendo agua. Si disuelves azúcar en agua, parece que haya desaparecido en la disolución. También sabes que si evaporas el agua, recuperas el azúcar. Y como puedes ver en la imagen, cuando el iodo sublima se producen vapores de iodo.
En todos esos casos se trata de procesos físicos, ya que el cambio producido no afecta a la naturaleza de las sustancias, que siguen siendo las mismas: las partículas están situadas más o menos cerca entre sí, pero siguen siendo las misma partículas (¡recuerda el modelo de partículas de la materia!).
Pero ¿sucede lo mismo cuando quemas madera, carbón, butano o la cera de una vela? ¿Y al añadir ácido sulfúrico concentrado a azúcar? Fíjate en las imágenes: en el caso de las combustiones, desaparece la sustancia que se quema, el combustible, y no hay forma de recuperarla, mientras que el azúcar queda carbonizado y tampoco se puede volver a obtener a partir de las sustancias formadas.
 |
 |
 |
Observa lo espectacular que resulta la deshidratación del azúcar por acción del ácido sulfúrico concentrado: se transforma en carbono (en forma de carbón) y en agua, pero como se produce una gran cantidad de calor, el vaso de precipitados llega a quemar y el agua se desprende en forma de vapor.
En estos casos se han producido reacciones químicas, que se caracterizan porque unas sustancias se transforman en otras diferentes.
Identificación de reacciones químicas
Para saber si se ha producido una reacción química, tienes que fijarte en si has observado alguno de los efectos siguientes: explosión, llama, formación de sólidos, desprendimiento de gas o cambio de color.
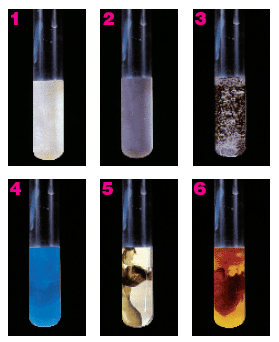 |
Formación de sólidos
En la imagen puedes ver la formación de seis sustancias poco solubles, y que, por tanto, dan lugar a un precipitado sólido cuando se mezclan disoluciones de sustancias muy solubles que contienen los iones que las forman.
Por ejemplo, si mezclas disoluciones de AgNO3 y de NaCl, que son dos sales muy solubles en agua, se encuentran en la misma disolución los iones Ag+ y Cl-, que dan lugar a un precipitado blanco de AgCl(s), que es una sal muy poco soluble (número 1 de la imagen).