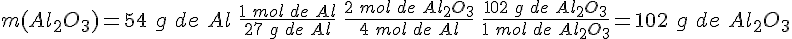5.1 Interpretación de ecuaciones químicas
 |
A escala de partículas, la ecuación química indica el número de partículas de cada tipo que reacciona. Pero ¿y a escala macroscópica?
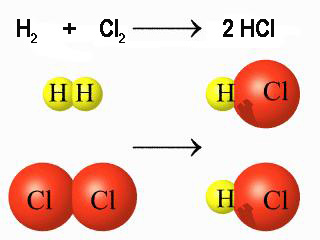
Fíjate en que si una molécula de hidrógeno reacciona con una de cloro, también reaccionarán NA moléculas de cada tipo. Pero como NA es el número de partículas que hay en un mol, puedes concluir que también reacciona un mol de cada sustancia.
Por tanto, también puedes decir que 2 gramos de hidrógeno (la masa de un mol de H2) reaccionan con 71 g de cloro (la masa de un mol de Cl2).
O de otra forma, que la proporción de combinación es de 71 g de cloro por cada 2 g de hidrógeno. Precisamente ¡la ley de las proporciones constantes!
De la misma forma, cuando el cloro reacciona con el sodio para formar cloruro de sodio, la proporción de combinación es de 71 g de cloro con 46 g de sodio (la masa de un mol de cloro reacciona con la masa de dos moles de sodio).
Cl2(g) + 2 Na(s) → 2 NaCl(s)
En las ecuaciones químicas
La proporción de combinación en partículas que se indica en una ecuación química coincide con la proporción de combinación en cantidades de sustancia, medida en moles.
La cantidad de sustancia se puede calcular de varias formas, según cuál sea la sustancia:
- En sólidos (y en general): n=m/M (cociente entre la masa y la masa molar).
- En sustancias disueltas: n=VC (producto de la concentración por el volumen).
- En gases: n=PV/RT (despejando en la ecuación de los gases).
Factores de conversión
Para evitar muchos de los errores que se cometen al realizar cálculos en las reacciones químicas, se utilizan los factores de conversión.
Un factor de conversión es una fracción que relaciona las cantidades de dos sustancias contenidas en la reacción química ajustada, o cantidades de distintas magnitudes de una misma sustancia.
El uso de los factores de conversión supone que debes establecer una secuencia de transformaciones que te facilitará la realización de los cálculos estequiométricos.

La oxidación del aluminio
Considera la reacción del aluminio con el oxígeno para formar óxido de aluminio, cuya ecuación ajustada es:
¿Qué masa de óxido de aluminio se obtiene a partir de 54 g de aluminio?