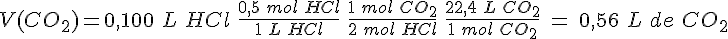5.2 Estudio de casos

|
Cuando se realizan cálculos con reacciones químicas se pueden plantear situaciones muy diferentes. A continuación se indican las más importantes.
Reactivos limitante y en exceso
Es muy habitual que no se consuma totalmente uno de los reactivos (en exceso), porque no hay suficiente cantidad de otro (limitante). Lo primero que hay que hacer es determinar cuál es el reactivo limitante, porque es el que determina la cantidad que reacciona o se produce del resto de sustancias.
Observa el quemador de gas. Como hay exceso de oxígeno, el gas se quema muy bien. Pero si hay escasez de oxígeno, la combustión es incompleta y se produce CO, gas muy nocivo, en lugar de CO2.
Reactivos impuros
Si un reactivo es impuro, solamente podrá reaccionar la masa correspondiente al porcentaje de pureza que tenga. Por ejemplo, si hay 50 g de reactivo del 80% de pureza, en realidad solamente hay 40 g puros para reaccionar.
Rendimiento de la reacción
Debido a circunstancias muy variadas, es muy habitual que no pueda reaccionar todo el reactivo puro que hay disponible. El rendimiento indica precisamente el porcentaje que efectivamente se transforma.
En disolución
Los reactivos se utilizan en disolución siempre que es posible, ya las reacciones son más rápidas. Lo único que hay que saber es la concentración de las disoluciones para realizar cálculos estequiométricos.
Con gases
En este caso, no hay mas que utilizar la ecuación de los gases para saber las cantidades de sustancia de reactivos y productos implicadas.
La pureza de una muestra de cinc
Para disolver 2,6 g de cinc impuro se han gastado 127 mL de una disolución de HCl con una composición en masa de 21,9 g/L. ¿Cuál es la riqueza (pureza) de la muestra de cinc? Las impurezas no reaccionan con el HCl(aq).
Masas atómicas relativas: H=1; Cl=35,5; Zn= 65,4
 |
Sintetizando amoniaco
El amoniaco se obtiene mediante el proceso de Haber-Bosch, por reacción entre el nitrógeno y el hidrógeno. Calcula la masa de amoniaco que se obtiene a partir de una mezcla de 140 g de dinitrógeno y 26 g de dihidrógeno, sabiendo que el rendimiento de la reacción, en las condiciones en que se produce, es del 25 %.
Masas atómicas relativas: H = 1; N = 14
|
23,2 g
| |
|
36,8 g
| |
|
52,6
| |
|
62,8
|