1. ¿Por qué se unen los átomos?
 |
Si los átomos interaccionan entre sí, originando distintos tipos de uniones entre ellos, es porque de esa forma son más estables que cuando se encuentran libres, desprendiéndose energía en la formación de enlaces interatómicos.
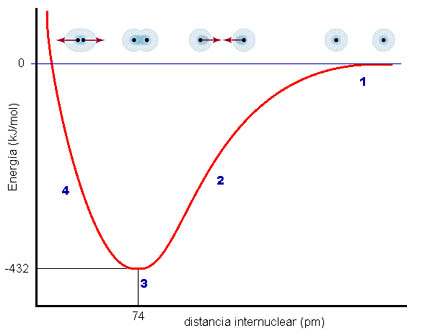
En primer lugar, vas a analizar por qué se unen los átomos. Imagina que tienes dos átomos A y B situados muy lejos uno de otro (las sustancias estarán en estado gaseoso). Entre los dos tienen una cantidad de energía determinada, y su energía de interacción es nula. Conforme se van acercando, interaccionan entre ellos, de forma que la situación va siendo progresivamente más estable, de menor energía, como puedes observar en la figura. A una distancia concreta, la energía es mínima porque la interacción es máxima entre los núcleos y los electrones de ambos átomos (la superposición de los orbitales atómicos hace aumentar la probabilidad de encontrar los electrones entre los núcleos, y eso se interpreta como que los dos átomos se han unido).
Si los átomos se acercan más, se hace muy apreciable la repulsión eléctrica entre los núcleos, cargados positivamente, con lo que la situación es menos estable. En resumen, los átomos quedan a una distancia concreta r0, que es la longitud de enlace (74 pm en la figura).
Acerca los átomos en el simulador siguiente y observa cómo actúan las fuerzas entre los átomos. Fíjate en que los átomos no se quedan a una distancia fija, sino que van oscilando con respecto a una posición de equilibrio, que es precisamente la distancia de enlace.
En resumen, los átomos se unen porque la energía que tiene un conjunto de átomos cuando están unidos es menor que cuando están separados.
La disminución de energía entre la situación de átomos separados y de átomos unidos tiene un significado real muy sencillo: para separar de nuevo los dos átomos habrá que comunicar precisamente esa cantidad de energía, llamada energía de enlace (432 kJ/mol en la figura).
Entender ese concepto no resulta intuitivo, pero seguro que te parece sencillo al plantearlo justo al revés: para separar dos partículas unidas hay que comunicar energía, que venza la fuerza de unión entre ellas (para separar dos bolas unidas por un muelle, hay que romper el muelle, lo que exige realizar una fuerza durante una determinada distancia; es decir, realizar trabajo, comunicando energía).
Evidentemente, si para que se realice un proceso (romper enlaces) hay que comunicar energía, cuando se forman enlaces se desprende energía, con lo que en la situación final hay menos energía que al principio.
Aspectos a resolver al estudiar el enlace
- ¿Por qué unos átomos reaccionan entre sí y otros no lo hacen? El cloro reacciona con el sodio, pero no con el neón.
- ¿Por qué en las sustancias iónicas hay una relación determinada entre el número de iones positivos y el de negativos? En el cloruro de sodio hay un ión Na+ por cada ión Cl-, pero en el sulfuro de sodio hay dos iones Na+ por cada ión S-2.
- ¿Por qué las moléculas constan de un número determinado de átomos, de uno o varios elementos? En el oxígeno hay dos átomos de oxígeno unidos, siendo O2 la fórmula que lo representa, mientras que el agua es H2O, no H3O.
- ¿Por qué las moléculas tienen una geometría característica? La molécula de CO2 es lineal y simétrica, mientras que la de H2O también es simétrica, pero angular, con un ángulo de enlace de 104,5º.
- ¿Por qué las energías de enlace son diferentes? Para romper un mol de enlaces en el nitrógeno hay que comunicar mucha más energía que para romper un mol de enlaces en el oxígeno.
-
¿A qué se deben las propiedades que tiene cada sustancia? El agua tiene un punto de ebullición mucho mayor del esperado, el diamante es la sustancia más dura en la escala de Mohs, los metales conducen la corriente eléctrica, etc.