3. Enlace metálico
Los metales se encuentran entre los tipos de sustancias más utilizados desde el comienzo de la civilización (¿recuerdas las edades del hierro o del bronce?), pasando por la revolución industrial del siglo XVIII y el desarrollo de la industria metalúrgica. Son muy frecuentes estructuras metálicas imponentes tales como los enormes puentes de ferrocarril o la misma Torre Eiffel.
Tampoco debes perder de vista que más del 80% de los elementos químicos son metálicos, por lo que es fundamental explicar el enlace en los metales.
 |
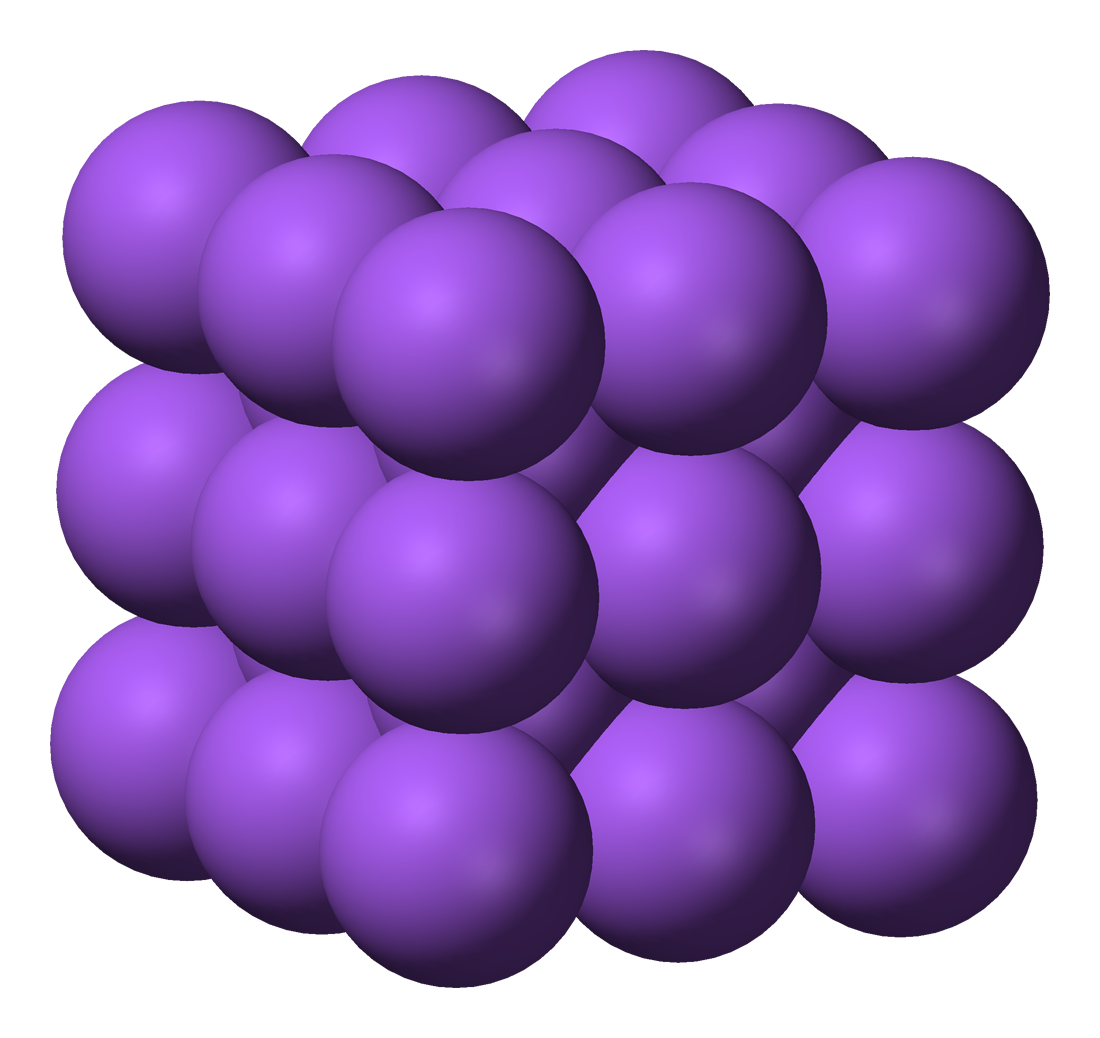 |
Modelo de Drude (1900)
Se utiliza el modelo del gas electrónico para explicar la estructura y propiedades de los metales. Según este modelo, los átomos metálicos pierden electrones para quedarse con la capa más externa completa, y esos electrones quedan libres ("deslocalizados") entre los iones positivos formados, que se ordenan formando estructuras similares a las iónicas, pero con todas las partículas iguales.
 |
Este modelo es muy sencillo y se usa porque permite explicar la propiedad más característica de los metales, su capacidad de conducción de la corriente eléctrica. Como los electrones tienen muy poca masa (más de cien mil veces menor que la de un ión de cobre), se mueven con facilidad por entre los iones. Si se someten dos puntos de un metal a una diferencia de potencial, los electrones se mueven con facilidad hacia el polo positivo, de mayor potencial. Este flujo de partículas cargadas en movimiento -electrones en este caso- es precisamente la corriente eléctrica.
La teoría de bandas
Esta teoría permite explicar no solamente la conductividad de los metales, sino las características semiconductoras del silicio, con una base similar a las teorías de enlace covalente. En esta página del IES Dolmen de Soto puedes ver de forma sencilla cómo se utiliza la teoría de bandas.