8. Fuerzas intermoleculares
Las propiedades de las sustancias moleculares indican que las fuerzas entre las moléculas que las forman son, en general, menos intensas que las que hay entre las partículas de las sustancias iónicas, metálicas o covalentes: la característica principal es que son gaseosas o líquidas a temperatura ambiente, y si son sólidas, son blandas y su dureza es baja o media.
Esas fuerzas intermoleculares reciben el nombre genérico de fuerzas de Van der Waals, y son las responsables de las propiedades físicas de las sustancias moleculares y de su estado de agregación: si no existieran, las moléculas se moverían desordenadamente por agitación térmica, sin ningún tipo de atracción entre ellas, y el estado físico sería siempre el gaseoso. En la naturaleza hay muchas sustancias moleculares en estado líquido, como el alcohol de quemar, la acetona, el ácido acético, el agua o la gasolina, o sólido, como el iodo, la mantequilla, etc.
Interacciones en sustancias moleculares
Enlaces químicos: interacciones electromagnéticas entre los átomos que dan lugar a una molécula y son las que determinan las propiedades químicas de la sustancia.
Fuerzas
intermoleculares: interacciones electromagnéticas entre las moléculas y son las
que determinan las propiedades físicas de la sustancia.
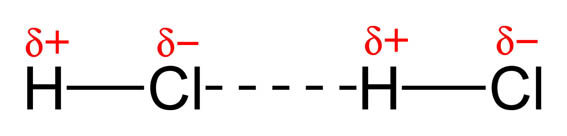
Las fuerzas intermoleculares se deben a interacciones entre dipolos, permanentes o instantáneos: por una u otra razón, los dipolos se orientan unos con respecto a los otros, de forma que los extremos positivos de unas moléculas se acercan a los negativos de otras, produciéndose una cierta ordenación en la sustancia.
|
|
a) Interacciones dipolares debidas a dipolos permanentes: se dan cuando las moléculas son polares, como sucede en el caso del HCl, agua, amoniaco, etc. Cuanto más polar sea la molécula, más intensas son la fuerzas intermoleculares.
Utiliza el simulador para variar la intensidad de la polaridad molecular, de la interacción exterior sobre ella y de la temperatura (aunque se habla de efecto magnético, tiene validez para el efecto de dipolo eléctrico que ahora nos interesa).
b) Interacciones dipolares debidas a dipolos instantáneos: se dan cuando las moléculas son apolares y son necesarias para explicar por qué una sustancia como el I2 es sólida a temperatura ambiente. Se llaman fuerzas dispersivas o de London y se dan entre cualquier tipo de molécula: entre moléculas de I2 solamente hay fuerzas dispersivas, pero entre moléculas de HCl hay fuerzas dipolares además de fuerzas dispersivas.
Fuerzas dispersivas
| |
¿Cuál es su origen? Las nubes electrónicas de las moléculas no están fijas, sino que se van distribuyendo entre los átomos unidos. Debido a esas redistribuciones, en un momento dado se produce en las moléculas una cierta separación de cargas, un dipolo instantáneo, que además induce dipolos instantáneos en las moléculas cercanas. Estos dipolos se orientan entre sí, dando lugar a una cierta interacción entre las moléculas: las fuerzas dispersivas.
Son poco intensas, y aumentan con la polarizabilidad, que mide la facilidad para la formación de dipolos instantáneos y que depende del número de electrones de la molécula. Como a mayor masa hay más electrones, se suele relacionar la magnitud de las fuerzas dispersivas con la masa molecular.
- Las fuerzas dipolares aumentan al hacerlo la polaridad de la molécula.
- Las fuerzas dispersivas aumentan al hacerlo la masa molecular.