2. Solubilidad de compuestos iónicos poco solubles
La solubilidad de una sustancia es la máxima cantidad de la misma que puede disolverse en un determinado volumen (o masa) de disolvente o disolución a una temperatura determinada. Corresponde a la concentración de la disolución saturada.
Los casos más interesantes son las disoluciones acuosas. La solubilidad de una sustancia en agua, a una temperatura dada, es un valor constante y característico de cada sustancia. Se mide generalmente en moles o gramos de sólido disuelto por litro de disolvente (mol/litro o gramos/litro). Por ejemplo, la solubilidad de la sal común (cloruro de sodio) es muy alta, de 359 gramos por litro de agua, de manera que el volumen de la disolución formada es mucho mayor de un litro al disolver los 359 g de sal.
Sin embargo, como vas a tratar sustancias poco solubles, al añadir una cantidad de sólido muy pequeña a un litro de agua, disolviéndose todo el sólido, el volumen de la disolución casi no varía, y sigue siendo prácticamente de un litro. Por esta razón, son equivalentes las medidas de solubilidad por litro de disolvente o por litro de disolución, con la ventaja en este último caso de que ya es una medida de concentración (moles de sólido disueltos por litro de disolución).
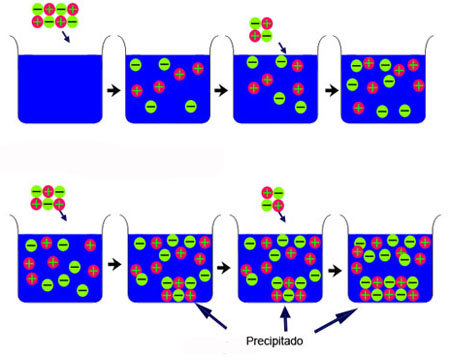
Observa la imagen. Al disolver sustancia, los iones se separan y se reparten por la disolución. Pero llega un momento en que ya no se disuelve más sólido, la disolución se satura y los cristales sin disolver precipitan al fondo del recipiente. Fíjate en que los iones son los mismos en el sólido y en la disolución.
|
|
Un ejemplo típico de estas últimas sales lo constituye el cloruro de plata, AgCl. Cuando está sal se añade al agua no se disuelve una cantidad apreciable de sólido. Una vez se alcanza el equilibrio entre el AgCl sólido y sus iones en disolución acuosa se dice que la disolución está saturada:
AgCl (s) + H2O ↔ Ag+ (aq) + Cl- (aq)
Vas a estudiar sustancias poco o muy poco solubles; es decir, al añadirlas a agua, la disolución se satura rápidamente, y no se disuelve más sólido. En realidad, se alcanza un estado de equilibrio entre los iones disueltos y los que quedan sin disolver en el sólido: existe un equilibrio dinámico, de modo que tantos iones como se disuelven por unidad de tiempo vuelven a precipitar, transformándose de nuevo en sólido; por tanto, la cantidad de iones por unidad de volumen de disolución permanece constante. En la animación se muestran todos estos aspectos.
 |
Sustancias poco solubles o muy solubles
Solamente vas a tener en cuenta la solubilidad de sales, hidróxidos y óxidos poco solubles. En todos los casos, se trata de compuestos iónicos, cuyo mecanismo de disolución en agua ya has visto al estudiar las propiedades de las sustancias.
Una sustancia se considera soluble si se puede preparar una disolución a 25 ºC con una concentración mayor de 0,1 mol/L sin que aparezca precipitado; es poco soluble si su concentración en disolución está entre 10-3 y 0,1 mol/L , y se considera muy poco soluble (o insoluble, aunque realmente todas las sustancias se disuelven algo) si su concentración en disolución es menor de 10-3 mol/L.
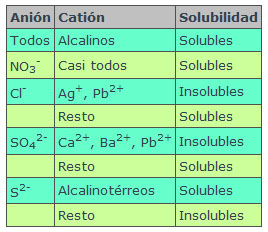
Es interesante tener una idea sobre la solubilidad de las sustancias con vistas a disponer de reactivos solubles en el laboratorio. Por ejemplo, si nos interesa poder preparar disoluciones de iones cloruro (Cl-), lo más sencillo es disponer de cloruro de sodio (NaCl), muy soluble y barato. En la tabla puedes ver la solubilidad de algunas sustancias.
|
En las disoluciones saturadas hay mucha sustancia disuelta.
| |
|
Al llegar al equilibrio, las reacciones de disolución y precipitación se detienen.
| |
|
Al evaporar agua de una disolución saturada se forma precipitado.
| |
|
Una disolución diluida admite todavía mucho soluto antes de saturarse.
|