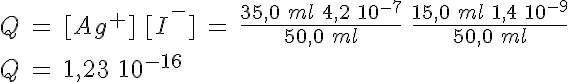3. Reacciones de precipitación
De forma similar a como viste en los gases, se define el producto iónico, Q, como el producto de las concentraciones de los iones presentes en una disolución dada, elevadas a sus correspondientes coeficientes estequiométricos.
Esta expresión del producto iónico, Q, es igual a la de la constante de solubilidad, Ks, pero con las concentraciones que hay en un instante concreto, no necesariamente en el estado equilibrio.
Por tanto, comparando los valores de Q y Ks podrás predecir el comportamiento de la disolución: si está en equilibrio, si se puede disolver más sustancia, etc.
Producto iónico y constante de solubilidad
| Q < Ks | La disolución no está saturada y puede disolverse más sólido: es la condición necesaria para que una sal se disuelva. |
| Q = Ks | La disolución está saturada: el sistema está en equilibrio y no se puede disolver más sal. |
| Q > Ks | La disolución está sobresaturada y el exceso de concentraciones iónicas dará lugar a la formación de sólido hasta que Q = Ks. Es la condición necesaria para que una sustancia precipite. |
|
|
¿Qué sucede cuando se mezclan dos disoluciones que contienen iones que forman un compuesto iónico poco soluble? Por ejemplo, al mezclar disoluciones de HgCl2 y de NaI, siendo ambas sustancias muy solubles, están presentes en la misma disolución los iones Hg2+ y I-.
Al verter una disolución sobre la otra, se observa la rápida formación de un producto insoluble de color naranja. Este sólido es yoduro de mercurio (II), HgI2, y se dice de él que es un precipitado. En la disolución permanecen los iones NO3- (aq) y K+ (aq), que son espectadores al no intervenir en la precipitación.
En este caso, el sistema en equilibrio es HgI2 (s) ↔ Hg2+ (aq) + 2 I- (aq). Fíjate en que ahora se trata de estudiar el proceso hacia la izquierda, la formación del sólido a partir de los iones en la disolución.
¿Qué condiciones deben cumplirse para que se forme HgI2, esa sustancia naranja muy poco soluble? No siempre que se mezclan las disoluciones se forma el precipitado: para que aparezca el sólido, las concentraciones de los iones que lo van a formar deben superar el nivel permitido por la Ks del compuesto poco soluble, es decir, Q debe ser mayor que Ks.
Debes tener en cuenta que en el proceso de mezcla se produce un efecto de dilución de los iones: si mezclas volúmenes iguales de dos disoluciones, sus concentraciones respectivas pasan a ser la mitad por el efecto de dilución.
Formación de precipitado
¿Se formará precipitado si se mezclan 15,0 ml de NaI 1,4 10-9 M y 35,0 ml de AgNO3 4,2 10-7 M?