Química 2º de BAC Tema 5. Equilibrios de solubilidad-precipitación
 |
En los temas anteriores has visto sistemas gaseosos en equilibrio, en los que todas las sustancias se encontraban en estado gaseoso a la temperatura de trabajo, como era el caso de la síntesis del amoniaco. Después, te has centrado en los equilibrios entre ácidos y bases, con todas las sustancias en disolución acuosa.
Si todos los reactivos y productos están en el mismo estado físico, el equilibrio es homogéneo, pero si uno o más reactivos o productos están en una fase diferente, el equilibrio es heterogéneo.
Son ejemplos de este último tipo los equilibrios entre sustancias sólidas y gaseosas:
o entre una disolución saturada y su precipitado:
Éste es el caso que vas a ver en este tema, en el que analizarás la solubilidad de compuestos iónicos poco solubles, por un lado, y la formación de precipitados de compuestos iónicos poco solubles, por otro.
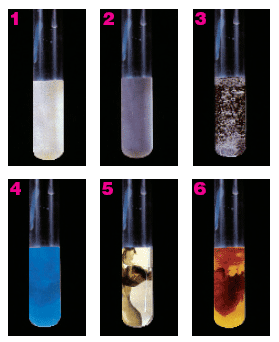
En la imagen puedes ver precipitados de colores característicos en tubos de ensayo: blancos, grises, azules, negros o rojizos. Estos colores permiten identificar los iones que había en disolución; por ejemplo, el precipitado azulado del tubo 4 será muy probablemente hidróxido de cobre(II), que tiene ese color.
Los equilibrios de solubilidad tienen gran importancia en Química. Permiten resolver problemas como la recuperación de sustancias muy caras que están en disolución, como el ion Ag+, o la detección y eliminación de las disoluciones de iones tóxicos para los organismos vivos. Otros procesos relacionados con equilibrios de solubilidad son la formación de cavernas de piedra caliza, el ablandamiento del agua dura, la formación de cálculos renales o las caries dentales, como verás en este tema.