5. Aplicaciones en el laboratorio
Separación de iones
 |
Si en una disolución hay varios iones, se pueden separar haciendo precipitar alguno de sus compuestos poco solubles.
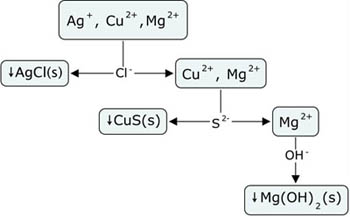
Fíjate en la imagen, en la que se muestra el procedimiento para separar tres iones que están presentes en la misma disolución.
Hay que diseñar un procedimiento para que al añadir un reactivo se forme precipitado de uno de ellos, que se separa por filtración, y los otros iones permanezcan en disolución. Se repite el proceso hasta separar todos los iones.
En primer lugar se añade Cl-, precipitando AgCl, que es el único cloruro insoluble. Después de filtrar, a la disolución resultante se le añade S2-, con lo que precipita el CuS. Este precipitado se filtra, quedando en disolución iones Mg2+, que se pueden precipitar en forma de hidróxido al añadir OH-.
Efecto salino
Cuando a una disolución de iones Ag+ se le añade disolución de iones Cl-, se forma un precipitado blanco de AgCl, que tiene una Ks de 1,8 10-10, estableciéndose el equilibrio:
Si posteriormente se añade disolución de iones S2- (Na2S, por ejemplo), se forma Ag2S, precipitado de color negro, que como tiene una Ks de 6 10-30 es mucho más insoluble que el AgCl, estableciéndose el equilibrio:
Ag2S (s) ↔ 2 Ag+ (aq) + S-2 (aq)
Como este segundo equilibrio se desplaza a la izquierda al formarse precipitado de Ag2S, desaparecen de la disolución los iones Ag+; por tanto, el primer equilibrio se desplaza a la derecha para formarlos. En resumen, se redisuelve el precipitado de AgCl blanco para formarse uno de Ag2S negro.
En resumen, por efecto salino desaparece un precipitado para formarse otro más insoluble.
Identificación de iones
Hay algunos precipitados que tienen una coloración característica que permiten identificar la presencia de los iones que los forman. Por ejemplo, como ya sabes, el PbI2 es de color amarillo canario; si se quiere saber si en una disolución hay iones Pb2+, se toma una muestra en un tubo de ensayo y se le añaden unas gotas de disolución de I-: si se forma precipitado, la identificación es positiva.
También se puede identificar la presencia de iones I- añadiendo Hg2+, debido al intenso color rojo característico del HgI2 (s). Y mediante la misma reacción, la existencia en disolución de iones Hg2+, añadiendo disolución de iones ioduro.
Determinación de concentraciones
 |
Algunas de las técnicas más desarrolladas en el trabajo de laboratorio se dirigen hacia la determinación de la concentración de una disolución. De esa forma se hace el análisis químico del agua mineral de la tarea, que nos indica los diferentes iones que hay disueltos y sus cantidades respectivas por litro de disolución.
La técnica más sencilla es la volumetría, en la que se mide el volumen de un reactivo de concentración conocida que reacciona totalmente con un volumen dado de una disolución de concentración desconocida. Cuando la reacción es de precipitación, se trata de volumetrías de precipitación.
Una de las más conocidas es el método de Mohr para determinar Ag+, que se utilizó durante muchos años para determinar la pureza de la plata en la Casa de Moneda de España. Se trata de la reacción que ya conoces en la que los iones Ag+ reaccionan con iones Cl- para formar AgCl.
Los iones complejos y su aplicación en Química
Se trata de compuestos en los que un ión de un metal de transición está unido a un conjunto de iones o moléculas que lo rodean, como es el caso del FeSCN2+, Ag(NH3)2+ o Cu(CN)42- La mayoría son muy solubles y tienen colores característicos; en la imagen puedes ver el color rojo sangre del FeSCN2+en comparación con el color producido por los iones Fe3+ que lo forman.
Por
ejemplo, cuando a una disolución que tiene iones Ag+ se le añade disolución de
NH3, se establece el equilibrio Ag+ + 2NH3 ↔ [Ag(NH3)2]+ para el que se define su constante de
equilibrio de formación.
Si la constante es muy grande, significa que el equilibrio está muy desplazado a la derecha, y que el complejo es muy estable y tiene una gran tendencia a formarse. El complejo [Ag(NH3)2]+ tiene una Kf de 108, el [Cu(NH3)4]2+ de 1012, el [Ag(CN)2]- de 1021 y el [Fe(CN)6]3- de 1031.
En el laboratorio tienen tres aplicaciones fundamentales:
1. Identificación de iones
Precisamente se utilizan esos colores para identificar iones: si a una disolución en la que se quiere investigar la presencia de iones Fe3+ se le añade unas gotas de disolución de SCN- y toma color rojo sangre, se puede asegurar que hay iones Fe3+, ya que son los únicos que producen esa coloración.
Algunos iones complejos tienen colores
específicos, y se utilizan para saber si en una disolución hay un ión concreto.
Por ejemplo, el [FeSCN]2+ tiene color rojo sangre, y solamente lo da
el Fe3+ cuando reacciona con el SCN- para formar ese
complejo. Por tanto, si a una disolución se le añade SCN- y se
produce color rojo sangre, podemos afirmar que hay disuelto Fe3+.
También es característico el color azul intenso del [Cu(NH3)4]2+.
2. Redisolución de precipitados
En un recipiente hay un precipitado blanco AgCl(s) ↔ Ag+(aq) + Cl-(aq). Si se añade NH3 concentrado se establece el equilibrio de formación de complejos Ag+ + 2NH3 ↔ [Ag(NH3)2]+ . Como se consumen iones plata para formar el complejo, el equilibrio de precipitación se desplaza a la derecha, de manera que si se añade suficiente amoniaco, se puede disolver todo el precipitado que había inicialmente.
3. Enmascaramiento de iones
Si a una disolución de AgNO3, sal muy soluble que produce Ag+(aq), se le añade una disolución que contiene Cl- (HCl, NaCl, etc), se forma precipitado de AgCl(s), estableciéndose el equilibrio AgCl(s) ↔ Ag+(aq) + Cl-(aq). Pero si previamente añadimos disolución de CN-, se forma el complejo [Ag(CN)2]- , que es más estable que el AgCl(s), y al añadir Cl- no se observa la formación de precipitado blanco de AgCl(s).
Es decir, la presencia del ión CN- ha enmascarado la presencia del Ag+ en la formación de AgCl(s), ya que hay Ag+, pero no reacciona y parece que no lo haya.