1.1 La regla del octeto
A principios del siglo XX se introdujo el papel del electrón en la capacidad de combinación de los átomos. En 1916 se precisó que al reaccionar elementos halógenos con alcalinos ambos átomos forman iones, uno positivo y otro negativo, adquiriendo ambos estructura electrónica de gas noble.
Esta estructura electrónica resulta particularmente estable, ya que los átomos de gases nobles no reaccionan en las condiciones químicas habituales (tienen las mayores energías de ionización), y son los únicos elementos que se encuentran en la naturaleza como átomos aislados en las condiciones estándar, sin formar moléculas.
Como la última capa electrónica de los gases nobles está completa con ocho electrones (excepto en el helio, que tiene dos), la tendencia a adquirir estructura de gas noble se conoce como regla del octeto.
|
 |
 |
¿Cómo se puede alcanzar la estructura de octeto?
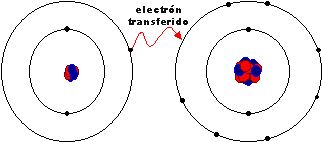
El octeto se puede alcanzar de dos formas. En primer lugar, por transferencia de electrones, cuando unos átomos pierden electrones formando cationes y otros los ganan dando lugar a aniones. Es necesario que la diferencia de electronegatividad entre los átomos sea suficientemente alta, para que el menos electronegativo pierda electrones y el más electronegativo los gane. Esto sucede cuando reaccionan los metales, elementos poco electronegativos, con no metales, que son muy electronegativos.
Sin embargo, cuando se ponen en contacto átomos de no metal, los dos tipos de átomos necesitan ganar electrones para completar su capa más externa: la única forma de completarla es compartir electrones, de manera que dos electrones que inicialmente eran uno de cada átomo, pasan a pertenecer ambos a los dos átomos, con lo que en definitiva cada uno está rodeado por un electrón más.
Fíjate en la imagen. Los pares de electrones se indican con dos puntos o una raya. Todos los átomos están rodeados por cuatro pares, excepto el hidrógeno, que solamente está rodeado por uno, ya que la primera capa electrónica no tiene mas que dos electrones. Por tanto, el hidrógeno debe estar siempre en posición terminal, unido a un solo átomo, ya que si se uniera a dos estaría rodeado por dos pares de electrones, más de los necesarios para completar su capa electrónica más externa (¡la primera!)

|
Excepciones a la regla del octeto
En 1962 se sintetizaron compuestos de los gases nobles, lo que echó por tierra la regla del octeto, ya que la estabilidad de esta estructura no existía de forma total. Por ejemplo, se obtuvieron los compuestos XeF4 y XePtF6, aunque en condiciones de temperaturas y presiones altas, que no son las habituales.
Además, hay compuestos muy habituales como el ácido nítrico y el sulfúrico, en los que el átomo central está rodeado por 5 o 6 pares de electrones (10 o 12 electrones), en lugar de por 4 pares, y otros como BeCl2 o BF3, en los que el átomo central está rodeado por 2 o 3 pares de electrones.
Estructuras de Lewis
Justifica las estructuras de Lewis de las moléculas de Cl2, H2O y CH4 que aparecen en una imagen anterior.