Física y química 1º de BAC Tema 1. Aspectos cuantitativos de la Química
El estudio de la naturaleza de las sustancias se abordó a finales del siglo XVIII y se desarrolló en la primera mitad del XIX, estudiando de forma sistemática y cuantitativa tanto procesos físicos (expansión de un gas) como químicos (reacción de metales con oxígeno). A partir de los resultados obtenidos, se elaboró un modelo que podía explicar las observaciones realizadas y que daba una visión conjunta de la estructura de las sustancias.
De esta forma, se puede llegar a entender la razón de las propiedades de las sustancias, e incluso existe la posibilidad de diseñar y obtener sustancias que tengan unas propiedades determinadas que resulten interesantes (desarrollo de nuevos materiales como el goretex, el kevlar, la fibra de carbono, etc).
¿Qué llegarías a ver si observases una sustancia como un cristal de sal común (sal gema) con un microscopio suficientemente potente? ¿Verías algo parecido a esto, típico modelo utilizado para representar la estructura de las sustancias? ¿Es cierto que la materia está formada por partículas?
 |
 |
El modelo de partículas de la materia
|
|
La idea de que la materia está formada por partículas muy pequeñas es consecuencia de la simple observación experimental: como un trozo de hierro se puede pulverizar y obtener así trozos de hierro más pequeños, es posible imaginar que, por sucesivas divisiones, puedes llegar a tener un trozo extraordinariamente pequeño, pero que sigue siendo de hierro; es decir, una partícula de hierro.
Esas partículas que constituyen la materia se mueven desordenadamente, tal y
como descubrió Brown en 1827, por lo que su movimiento se llama browniano.
Existen muchas pruebas de que ese planteamiento es correcto, observables sobre
todo en sustancias gaseosas o líquidas.
En el vídeo se ven partículas en el humo de un cigarrillo.
 |
Aspectos clave del modelo de partículas
-
La materia está formada por partículas, muy pequeñas e iguales entre sí para cada sustancia.
-
Hay grandes espacios vacíos entre ellas, por el que se mueven desordenadamente, con velocidades que dependen del estado físico (mayores en el gaseoso y pequeñas en el sólido).
-
La temperatura es la manifestación macroscópica del movimiento de las partículas: al aumentar la temperatura, también lo hace la velocidad de las partículas.
-
El choque de las partículas de un gas con las paredes del recipiente que las contiene es la causa de la presión generada. Si las partículas son grandes su velocidad es menor, y sin son pequeñas, mayor.
|
|
En el simulador siguiente se representan las partículas de un gas en un recipiente, y puedes cambiar el volumen, la temperatura y el número de partículas para ver cómo varía el número de choques por unidad de tiempo con la pared derecha, que es una medida de la presión generada por el gas en el recipiente.
¿Cómo afecta cada una de esas magnitudes a la presión del gas? No tienes mas que observar lo que sucede y tener en cuenta el modelo de partículas de la materia.
 |
Explicación de hechos experimentales
Utilizando este modelo tan sencillo es posible explicar una gran cantidad de fenómenos que suceden en nuestro entorno.
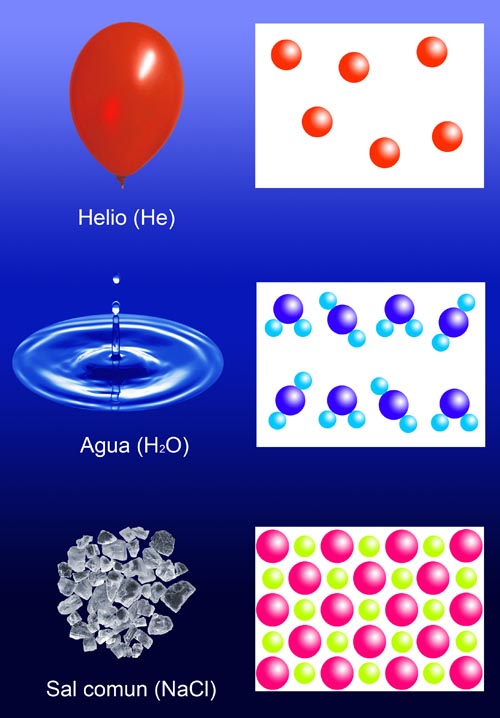
Fíjate en la imagen de la derecha: el helio es un gas, y sus partículas están muy alejadas entre sí. Por tanto, la densidad del helio, como la de todos los gases, es baja.
El agua es líquida, y las partículas de agua están bastante más cerca entre sí, por lo que la densidad de los líquidos es mucho mayor que la de los gases.
Por último, las partículas que forman el cloruro de sodio, sólido, se encuentran muy cerca entre sí, por lo que la densidad es la mayor. Metales como el iridio o el platino tienen densidades del orden de 22 g/cm3, mientras que la del agua es de 1 g/cm3, y la del aire es de 0.0013 g/cm3.
¿Cómo se producen los cambios de estado? Al comunicar energía en forma de calor a un sólido, las partículas se mueven más deprisa, con lo que se alejan entre ellas y van venciendo las fuerzas que las mantienen cerca en el estado sólido. Llega un momento en que el estado físico es el líquido. Algo similar sucede al pasar los líquidos al estado gaseoso, como has podido ver antes.
Hinchando y deshinchando globos
Ahora seguro que te resulta sencillo explicar por qué se hincha el globo al calentar o por qué se deshincha cuando se extrae el aire del frasco con la bomba de vacío.
 |
|