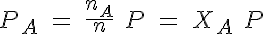5. Ecuación de los gases ideales
La constante de la ecuación de los gases PV/T=cte es nR, donde n es la cantidad de sustancia de gas y R la constante de los gases, que es 8,31 J.K-1.mol-1 si las unidades son las del Sistema Internacional (S.I.) -presión en pascales (Pa ó N/m2) y volumen en m3- y 0,082 atm.L.K-1.mol-1 si la presión se mide en atmósferas (atm) y el volumen en litros (L), que es lo más habitual.
De esta forma, la ecuación de los gases ideales se suele escribir como PV=nRT.
Si la cantidad de sustancia es de un mol y las condiciones son las llamadas normales (P=1 atm y T=273 K), el volumen que ocupa un mol de gas (su volumen molar) es de aproximadamente 22,4 L/mol.
Cantidad de sustancia, masa, partículas y volumen en condiciones normales
Un mol de cualquier sustancia tiene una masa de M gramos (M es la masa molar en g/mol), contiene NA partículas (NA es el número de Avogadro) y, si es un gas, ocupa 22,4 L en condiciones normales.
El volumen molar
Comprueba que el volumen molar en condiciones normales es de 22,4 litros.
Ley de Dalton
Utiliza el simulador siguiente para estudiar algunas propiedades de los gases y comprobar que se cumple la ley de Dalton de suma de las presiones parciales.
1. Coloca en el primer recipiente 0,01 mol de gas. Calcula el volumen del erlenmeyer. ¿Qué presión total marca el cuarto rerlenmeyer?
2. Repite el proceso para los otros dos recipientes. ¿Depende la presión del tipo de gas?
3. Coloca ahora 0,01 mol en cada uno de los tres recipientes y observa qué presión hay en el cuarto erlenmeyer. Compárala con la suma de las que marcan los otros.
Puedes trabajar ahora con la cantidad que quieras de cada uno de los tres gases. Observa lo que sucede en este caso.
Los gases reales
Todos los planteamientos del modelo de los gases se basan en que las partículas que los forman son muy pequeñas en comparación con el tamaño del recipiente que las contiene y en que entre ellas no hay fuerzas atractivas. Los gases que siguen las ecuación de los gases (PV=nRT) se llaman gases ideales.
Pero hay casos en que no se sigue la ecuación
anterior, por lo que se dice que se trata de un gas real y la ecuación
hay que modificarla introduciendo factores de corrección para llegar a la ecuación de los gases reales o de Van der Waals.
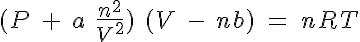
No van a surgir casos en que tratemos con gases reales, pero son muy habituales: piensa en un gas que se comprime a alta presión, tanto que sus moléculas llegan a estar tan cerca que interaccionan entre ellas e incluso el gas puede licuar, como sucede con los gases combustibles que se venden licuados en bombonas.
Presiones parciales y fracción molar
Según el principio de Avogadro, la presión solamente depende de la cantidad de sustancia de gas, pero no de qué gas se trata, y es proporcional a la cantidad de sustancia que hay de ese gas en un recipiente de volumen V a una temperatura T, de acuerdo con la ecuación de los gases.
¿Y si en el recipiente hay dos o más gases? Ya has visto que la presión total en la mezcla es la suma de las presiones parciales, y puedes calcular cada una de ellas aplicando la ecuación de los gases a cada uno de los gases de la mezcla.
También puedes utilizar el principio de Avogadro: si en una mezcla de dos gases A y B hay nA moles de A y nB moles de B, que generan respectivamente unas presiones parciales de PA y PB, la cantidad total de sustancia y la presión total son, repectivamente, n = nA + nB y P= PA + PB.
Como nA moles de A generan una presión PA y los n moles totales generan una presión P, en recipientes del mismo volumen y temperatura:
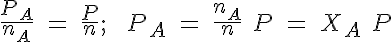
donde XA es la fracción molar del gas A en la mezcla.
Presión parcial de un gas en una mezcla
Se puede calcular aplicando la ecuación de los gases como si el gas estuviera solo en el recipiente, o bien mediante la fracción molar y la presión total.