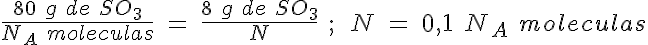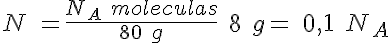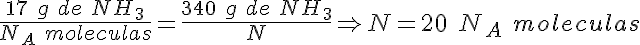4. La cantidad de sustancia
Al trabajar con una sustancia cualquiera, habitualmente necesitamos medir una determinada cantidad para disolverla, hacerla reaccionar, etc. En el caso de sólidos, lo más sencillo es pesarlos, mientras que en el caso de líquidos o disoluciones es habitual medir volúmenes. Si se trata de gases, se miden volúmenes en unas determinadas condiciones de presión y temperatura. Es decir, desde el punto de vista práctico se trabaja con magnitudes a escala macroscópica: masas y volúmenes.
 |
Por otro lado, el modelo de materia que has visto utiliza partículas extraordinariamente pequeñas, que sirven para explicar tanto procesos físicos como reacciones químicas. Por ejemplo, decimos con naturalidad que "una partícula de la sustancia X reacciona con dos partículas de la sustancia Y". Para interpretar lo que sucede en los procesos se trabaja a escala microscópica, a escala de partículas.
¿Cuántos átomos de cobre hay en el trozo de cobre nativo que se ve en la imagen? Puedes medir la masa de cobre, pero ¿puedes contar el número de átomos?
El problema es que no es posible contar partículas: el tamaño de los átomos es del orden del amstrong (10-10 metros, de forma que diez mil millones de átomos en fila alcanzarían un metro).
Se define la magnitud cantidad de sustancia para poder relacionar masas o volúmenes de sustancias, que se pueden medir a escala macroscópica, con el número de partículas que hay en esa cantidad. Eso es lo que interesa saber desde el punto de vista de las reacciones químicas y que, debido a su tamaño extraordinariamente pequeño, no es posible contar.
La cantidad de sustancia
Su unidad es el mol, que se define como "la cantidad de sustancia de un sistema que contiene tantas entidades elementales como átomos de carbono hay en 0.012 kg de carbono-12" (IUPAC 1967, BOE de 3-11-1989). El término entidad elemental se refiere a partículas, que pueden ser átomos, moléculas o iones.
La magnitud cantidad de sustancia se simboliza por n, mientras que su unidad mol no tiene abreviatura, y se escribe mol. De esta forma, se escribe n(agua)= 2 mol, que significa que la cantidad de sustancia de agua es de 2 mol (ó 2 moles).
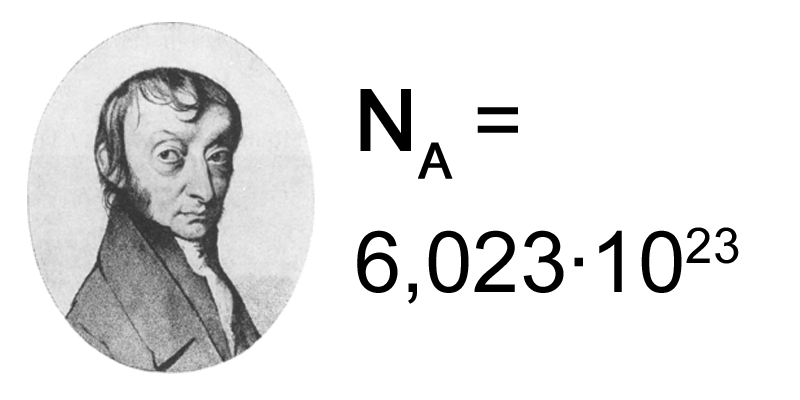 |
El número de Avogadro
El número de partículas que hay en un mol se llama número de Avogadro, NA, y es 6,023 1023 partículas por mol. ¿Por qué se ha elegido ese valor y no otro más sencillo, como 1020 por ejemplo?
La masa relativa de una partícula indica cuántas veces es mayor su masa que la que se toma como referencia (la doceavaparte de la masa atómica del isótopo 12 del carbono). Es el dato que aparece en la tabla periódica para los átomos, y que se usa para determinar la masa de partículas poliatómicas.
Por ejemplo, mr(H2O)= 18 significa que una molécula de agua tiene una masa 18 veces mayor que la masa unidad. Mientras no se sepa cuál es el valor de esa masa unidad, no hay forma de saber la masa de la molécula de agua, que se indica como 18 u, donde u es la masa real de la unidad de masa atómica.
Pero como la masa unidad es de 1,660 10-24 g, la masa real de la molécula de agua es de 18 1,660 10-24 g. Este número no tiene ninguna utilidad en Química desde el punto de vista práctico, porque no se puede disponer de moléculas de agua aisladas.
Si en un vaso echas el número de Avogadro de moléculas de agua, ¿qué masa de agua tienes? Evidentemente, será la masa molar, es decir, la masa de una molécula multiplicada por el número de moléculas que hay en un mol de sustancia:
18 1,660 10-24 g/molécula 6,023 1023 moléculas/mol = 18 g/mol
Fíjate en que el resultado numérico es 18. Es decir, el número de la masa relativa se mantiene en la masa real y en la masa molar, aunque tiene significados diferentes en los tres casos.
|
mr(H2O)=
18 |
m(H2O)=
18
u |
M(H2O)= 18 g/mol |
¿Por qué el número de Avogadro es 6,023 1023?
Para mantener el mismo número para la masa relativa, la masa real y la masa de un mol (masa molar, M), aunque el significado de las tres magnitudes es diferente.
Su valor, 6,023 1023, es exactamente el inverso de la unidad de masa atómica, 1,660 10-24 g.
Errores terminológicos
Fíjate en las expresiones siguientes, porque son incorrectas:
| 1 mol (O2) = 32 g | |
1 mol (O2) = NA moléculas |
¡Estás igualando magnitudes diferentes: cantidad de sustancia con masa o con número de partículas! Eso sí, te estás refiriendo en todos los casos a la misma cantidad de oxígeno.
Las expresiones siguientes son correctas:
| n (O2) = 1 mol | |
m (O2) = 32 g |
|
N (O2) = NA moléculas |
¿El número de moles?
De esta forma, se puede decir n(agua)= 2 mol, que significa que la cantidad de sustancia de agua es de 2 mol (ó 2 moles).
Es incorrecto decir que el número de moles es 2. Por ejemplo, cuando se mide la longitud de una mesa se escribe l(mesa)= 1,5 m, que significa que la longitud de la mesa es de 1,5 m, no que el número de metros de la mesa sea 1,5. Sin embargo, es extraordinariamente frecuente encontrar la expresión "el número de moles es" en lugar de "la cantidad de sustancia es".
La masa molar y la masa de una partícula
 |
La masa molar de una sustancia (M) es la masa en gramos que tiene un mol de esa sustancia. Se mide en g/mol.
Es muy fácil saber su valor, ya que M coincide numéricamente con la masa relativa de la partícula, aunque tiene un significado diferente: si la masa relativa del CO2 es 44, su masa molar M es 44 g/mol.
Y como en un mol de cualquier sustancia hay el número de Avogadro de partículas, NA, que tienen una masa de M (masa molar), es sencillo calcular la masa de una partícula de la sustancia: no tienes mas que hacer el cociente entre la masa total y el número de partículas por mol.
Para calcular masas y números de partículas
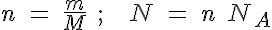 |
n=cantidad de sustancia m=masa de sustancia M=masa molar N=número de partículas NA=número de Avogadro |
Debes tener mucho cuidado a la hora de aplicar estás fórmulas, porque si no tienes las ideas claras, puedes confundirte fácilmente: fíjate en que los símbolos de las magnitudes son letras ene y eme, mayúsculas o minúsculas, y hasta con subíndices.
Es más recomendable utilizar proporciones o factores de conversión para determinar las magnitudes que necesites. En todo caso, y dado que deberás calcular con mucha frecuencia la cantidad de sustancia sabiendo la masa o al revés, la primera fórmula te puede resultar útil.
La masa de una molécula de SO3
El SO3 es uno de los gases más contaminantes y tóxicos que hay en la atmósfera. Se produce en la combustión de diferentes sustancias que contienen pequeñas cantidades de azufre.
Calcula cuántas moléculas hay en 8 g de SO3, así como la masa de una de esas moléculas.
Masas y partículas en el amoniaco
¿Qué masa tiene una molécula de amoniaco, NH3? ¿Cuántas moléculas hay en un recipiente que contiene 340 g de gas amoniaco?
Cobre y oxígeno
Además de que es la misma cantidad de sustancia, ¿qué tienen en común un mol de cobre y un mol de oxígeno?
Lingotes de plata
Determina cuántos átomos de plata hay en un lingote de plata de 1000 g.