Física y química 1º de BAC Tema 2. Reacciones químicas
Al echar un vistazo a tu alrededor, puedes observar cómo se encuentra en continuo cambio. Ya sea de forma espontánea, al mezclar o al calentar sustancias, se producen cambios en ellas.
Sin embargo, si observas estos cambios más detenidamente, puedes encontrar algunos que no modifican la naturaleza de la sustancia original, como por ejemplo el charco de agua que va desapareciendo al evaporarse o la disolución de una cucharada de sal en un vaso de agua, en los cuales no cambia la naturaleza de las sustancias presentes. Lo mismo ocurre con los procesos de fabricación de útiles de aluminio y su reciclado.
En otros casos, el cambio es mucho más drástico: el resultado es una sustancia absolutamente
diferente a la inicial. Algunos ejemplos de estos
cambios son la combustión de la madera en una hoguera, la aparición de
óxido en la superficie de un clavo de hierro o la obtención de metales como el aluminio a partir de sus menas minerales.
Cambios físicos y cambios químicos

|
 |
Los cambios en la materia pueden ser de dos tipos:
Físicos: son aquellos en los que no se producen cambios en la naturaleza de la materia que interviene, es decir, la composición de la sustancia es la misma antes que después del cambio. Ejemplos de cambios físicos son:
- Los cambios de estado.
- La disolución de un sólido.
- La separación de mezclas.
Químicos: en ellos el cambio es mucho más drástico, modificándose la naturaleza de la materia misma. En un cambio de este tipo desaparecen unas sustancias y aparecen otras nuevas. También reciben el nombre de reacciones químicas.
Identificando cambios químicos
Indica de entre los siguientes cambios cuáles de ellos son cambios químicos:
Obtención del aluminio a partir de la bauxita.
| |
Fabricación de una lata de refresco a partir de una lámina de aluminio.
| |
Encender una bombilla. | |
Hacer la digestión.
| |
¿Cambio físico o reacción química?
Es casi seguro que se produce una reacción química cuando se quema una sustancia, precipita un sólido, se desprende un gas en una disolución, se genera luz o calor, se transforma visiblemente una sustancia como el hierro cuando se oxida, etc.
Pero en muchas ocasiones es difícil distinguir si un cambio producido en la materia corresponde a un cambio de tipo físico o a una reacción química, sobre todo si no hay cambios visibles.
Por esa razón
es necesario un criterio que permita dicha distinción sin lugar a
dudas. La mejor solución es utilizar el modelo de partículas para observar el
cambio a escala de partículas, teniendo en cuenta que en una reacción
química se produce una ruptura de enlaces entre los átomos de los
reactivos con una posterior creación de nuevos enlaces que dan lugar a
los productos.
Por lo tanto, hay que analizar si se observan cambios o no en el
diagrama de partículas del proceso: si no los hay, se trata de un
proceso físico, pero si cambian las partículas, es una reacción
química.
Las reacciones químicas
Las partículas no son visibles, sea cual sea el estado físico en que se encuentren las sustancias. Cuando las sustancias reaccionan y se transforman en otras diferentes, lo único que se puede hacer es observar los productos de la reacción.
Observa cómo se quema el magnesio al reaccionar con el oxígeno del aire por acción del calor. Se forma una sustancia blanca pulverulenta, que nada tiene que ver con el aspecto metálico del magnesio.
|
|
|
El modelo de partículas permite interpretar cómo unas sustancias se transforman en otras diferentes, aunque las partículas que las constituyen no sean visibles.
La teoría atómico-molecular supone que las sustancias están formadas por átomos, moléculas o iones. Una reacción química se produce cuando los átomos que forman las sustancias originales, llamadas reactivos, se recombinan para dar lugar a unas nuevas sustancias denominadas productos. Una ecuación química es una representación simbólica de una reacción química.
También informa sobre las cantidades relativas de las sustancias que intervienen en la reacción, indicadas por los denominados coeficientes estequiométricos, números que se colocan delante de cada fórmula para indicar cuanta sustancia de cada tipo reacciona. En el caso de que tengan valor unidad, se omiten.
En una ecuación química figuran dos miembros: en el primero, las fórmulas de los reactivos, y en el segundo, las de los productos. Para separar ambos miembros se utiliza una flecha, que generalmente se dirige hacia la derecha, indicando el sentido de la reacción:
Además, suele indicarse el estado físico en el que se encuentran las diferentes sustancias participantes, mediante unos símbolos que se colocan entre paréntesis detrás de cada una de ellas. Estos símbolos son:
- (s): indica que la sustancia está en estado sólido.
- (l): indica que la sustancia está en estado líquido.
- (g): indica que la sustancia en estado gaseoso.
- (aq): indica que la sustancia se encuentra disuelta en agua.
Se dice que una ecuación química está ajustada cuando el número de átomos de cada elemento en cada uno de los lados de la ecuación es el mismo. Es decir, hay el mismo número de átomos de cada tipo en reactivos y en productos, con lo que la masa evidentemente se conserva. Observa la reacción de síntesis del NO y justifica el cambio del tipo de partículas conservándose el número total de átomos de cada elemento químico.
Fíjate en la reacción de combustión del etano. Comprueba que hay el mismo número de átomos de C, H y O en reactivos y en productos.
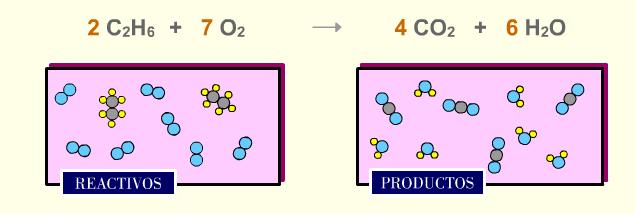 |
Ajustando ecuaciones de reacciones químicas
El proceso que debes seguir para ajustar una ecuación química es el siguiente:
-
Escribe la reacción en la forma Reactivos → Productos.
-
Observa los átomos de cada tipo que hay a cada lado de la reacción.
-
Si hay algún tipo de átomo que no está compensado, añade el coeficiente estequiométrico correspondiente para que el número se iguale. En caso que haya más de un tipo, comienza por el que pertenezca a la partícula más compleja.
-
Comprueba si la inclusión de este coeficiente ha descompensado algún otro tipo de átomo, y repite el proceso hasta que consigas que el número de átomos de cada tipo sea el mismo a ambos lados.
Ecuaciones químicas y proporciones de combinación
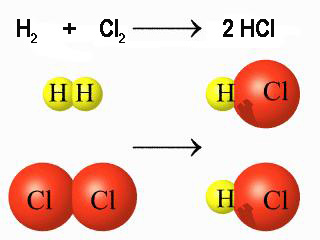 |
A escala de partículas, la ecuación química indica el número de partículas de cada tipo que reacciona. Pero ¿y a escala macroscópica?
Fíjate en que si una molécula de hidrógeno reacciona con una de cloro, también reaccionarán NA moléculas de cada tipo. Pero como NA es el número de partículas que hay en un mol, puedes concluir que también reacciona un mol de cada sustancia.
Por tanto, también puedes decir que 2 gramos de hidrógeno (la masa de un mol de H2) reaccionan con 71 g de cloro (la masa de un mol de Cl2).
O de otra forma, que la proporción de combinación es de 71 g de cloro por cada 2 g de hidrógeno. Precisamente ¡la ley de las proporciones constantes!
De la misma forma, cuando el cloro reacciona con el sodio para formar cloruro de sodio, la proporción de combinación es de 71 g de cloro con 46 g de sodio (la masa de un mol de cloro reacciona con la masa de dos moles de sodio).
Cl2(g) + 2 Na(s) → 2 NaCl(s)
La cantidad de sustancia en las ecuaciones químicas
La proporción de combinación en partículas que se indica en una ecuación química coincide con la proporción de combinación en cantidades de sustancia, medida en moles.
La cantidad de sustancia se puede calcular de varias formas, según cuál sea la sustancia:
- En sólidos (y en general): n=m/M (cociente entre la masa y la masa molar).
- En sustancias disueltas: n=Vc (producto de la concentración por el volumen).
- En gases: n=PV/RT (despejando en la ecuación de los gases).