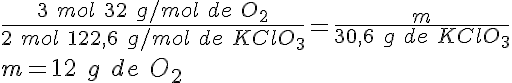3. Cálculos en las reacciones químicas
 |
La parte de la Química que estudia las relaciones cuantitativas entre los reactivos y los productos que intervienen en una reacción química se denomina estequiometría.
El término estequiometria -del griego "στοιχειον" = stoicheion (elemento) y "μετρον"=métrón, (medida)- fue introducido por primera vez por Richter en 1792.
Cuando quieres obtener una cantidad de un producto determinado necesitas saber qué cantidad de reactivo debes utilizar o, a la inversa, dispones de una cantidad de reactivo y quieres saber cuánto producto puedes obtener. Las ecuaciones químicas ajustadas te proporcionan la información cuantitativa necesaria para dar respuesta a esas cuestiones.
Las distintas operaciones matemáticas que permiten calcular la cantidad de una sustancia que reacciona o se produce en una determinada reacción química reciben el nombre de cálculos estequiométricos.
 |
Una reacción se produce en condiciones estequiométricas cuando las cantidades de reactivos están en las proporciones idénticas a las de la ecuación química ajustada.
Como ejemplo, considera la reacción del aluminio con el oxígeno para formar óxido de aluminio, que se utiliza en los fuegos artificiales para conseguir chispas plateadas. La ecuación química ajustada es:
Esta ecuación puedes leerla a escala de partículas: cuando el aluminio reacciona con el oxígeno, cuatro átomos de aluminio reaccionan con tres moléculas de oxígeno para formar dos partículas de óxido de aluminio (como es una sustancia iónica, forma una estructura gigante en la que la fórmula indica la proporción de iones en la sustancia, pero no hay ninguna unidad individual que corresponda a esa fórmula).
Si en lugar de 4 átomos de Al dispones de 4 veces el número de Avogadro de átomos (de 4 moles de Al), reaccionarán con 3 moles de O2 y se formarán 2 moles de Al2O3. Es decir, la proporción en partículas y en moles es la misma.
Mediante esa relación estequiométrica podrás calcular la cantidad de producto o de reactivo, según te interese.
La proporción de combinación en cantidad de sustancia
Utiliza el siguiente simulador para observar cómo va evolucionando una reacción en función de su estequiometría y de las cantidades de sustancia de reactivos de partida. Desliza la barra para simular el avance de la reacción y justifica en cada momento las cantidades presentes de reactivos y productos.
Para realizar cálculos estequiométricos
Los datos sobre los reactivos y
los productos no se expresan, normalmente, en cantidad de sustancia (moles),
sino que se expresan en masa (gramos) o en volumen (litros) de disolución o de
un gas. Por ello, es necesario seguir un procedimiento en los cálculos
estequiométricos.
Los pasos a seguir son:
1º- Escribe la ecuación química ajustada.
2º- Calcula la cantidad de sustancia en moles de la sustancia dato.
3º- Usa la relación estequiométrica para obtener la cantidad de sustancia en moles de la sustancia incógnita.
Estos pasos se pueden realizar de tres formas:
1. Siguiendo los pasos anteriores, calculando cantidades de sustancia que en la mayoría de los casos no necesitas saber, y realizando los cálculos intermedios por separado.
2. Aplicando la ley de las proporciones constantes, que simplifica el cálculo porque se realizan conversiones intermedias de cantidades de sustancia de forma directa.
3. Utilizando factores de conversión, que no es mas que una forma más elegante de aplicar la ley anterior, que en una única operación permite presentar todos los cálculos.
 |
Siguiendo con el ejemplo, ¿qué masa de óxido de aluminio se obtiene si reaccionan 54 g de aluminio con suficiente oxígeno?
1º- La ecuación química ajustada es la que has escrito anteriormente:
2º- El dato son los 54 g de aluminio que reaccionan. Como la masa molar del aluminio es M(Al) = 27 g/mol, la cantidad de sustancia de aluminio es:
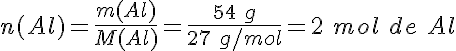
3º- La relación estequiométrica entre el aluminio (dato) y el óxido de aluminio (Al2O3) (incógnita) es:

Si despejas la cantidad de sustancia de Al2O3,

4º- Como te piden la masa de Al2O3 que se obtiene, calculas la masa molar del Al2O3, M(Al2O3) = 102 g/mol, y al final resulta:

 |
Las lámparas de acetileno
En espeleología se usan como iluminación principal las lámparas de acetileno (etino). La reacción que se produce en ellas es: el carburo de calcio (CaC2) reacciona con el agua (H2O) para formar hidróxido de calcio (Ca(OH)2) y acetileno (C2H2). ¿Qué masa de acetileno obtendrás si haces reaccionar 54 g de agua con suficiente carburo?
¿Qué masa de Ca(OH)2 se producirá?
 |
Descomponiendo clorato de potasio
Para obtener oxígeno en el laboratorio se descompone el clorato de potasio (KClO3) en cloruro de potasio (KCl) y oxígeno (O2), calentando en presencia de un catalizador. ¿Qué masa de oxígeno obtendrás si descompones 30,6 g de KClO3?