1. Formulación y nomenclatura de compuestos inorgánicos
La nomenclatura química tiene como objetivo describir las sustancias químicas mediante nombres y fórmulas que permitan identificarlas sin ambigüedad, facilitando así la comunicación científica.
Desde los primeros tiempos, los alquimistas fueron dando nombres a los elementos y a las sustancias simples y compuestas, y les asignaron un símbolo, que con frecuencia se refería a aspectos de la mitología o de la naturaleza de las sustancias (aceite de vitriolo, agua fuerte, ...).
A mediados del siglo XVIII, la química se desarrollaba y los nombres y símbolos de las sustancias químicas no facilitaban la comunicación entre los químicos. En 1787, basada en las ideas de Guyton de Morveau y firmada por los químicos más importantes de la época (Lavoisier, Fourcroy, Berthollet y él mismo), se publicó la obra, Méthode de nomenclature chimique, que fue el inicio de una nomenclatura sistemática.
A principios del siglo XIX, J.Berzelius introdujo una nueva nomenclatura, ya con fórmulas muy parecidas a las actuales.
En el siglo XX, la Unión
Internacional de Química Pura y Aplicada (International Union of Pure
and Applied Chemistry), IUPAC, a través de sus comisiones para la
nomenclatura inorgánica, orgánica y bioquímica, ha sido la encargada de dar las
normas para la nomenclatura y formulación de las sustancias químicas. Las últimas,
hasta el momento, se publicaron en 2007 en la versión en español.
 |
Electronegatividad y orden de escritura en las fórmulas
En las fórmulas químicas de los compuestos inorgánicos formados al menos por dos elementos diferentes, la posición de los elementos sigue el orden creciente de electronegatividad, que es una medida de la capacidad de un átomo o grupo de átomos para atraer los pares de electrones compartidos en un enlace.
Los no metales son elementos con electronegatividad alta, ya que captando pocos electrones completan su capa electrónica más externa. Por otro lado, los metales tienen electronegatividad baja, ya que tienen que perder pocos electrones para que su capa exterior quede completa. Los gases nobles no tienen electronegatividad, puesto que como no forman enlaces no es posible medir su electronegatividad.
Números de oxidación
El número de oxidación de un átomo en una molécula (el C en el CO2) o en un ión poliatómico (el S en el SO42-) es un número positivo o negativo, que representa la carga que quedaría en el átomo dado, si los pares electrónicos de cada enlace que forman se asignaran al elemento más electronegativo del par de enlace. En el caso de iones monoatómicos, es la carga del ión.
Los números de oxidación están relacionados con la estructura electrónica de los átomos y su tendencia a ganar o perder electrones para completar la capa electrónica más externa (regla del octete).
Recuerda que la estructura está directamente relacionada con la posición en la tabla periódica: el número de electrones de la capa más externa coincide con el número del grupo en los metales (elementos de la izquierda de la tabla, poco electronegativos) o con el número de electrones que falta para completarla en los no metales (elementos de la derecha).
Se utilizan los convenios siguientes:
- El número de oxidación del hidrógeno es +1 cuando se combina con elementos no metálicos (-1 cuando se combina con elementos metálicos formando hidruros).
- El número de oxidación del oxígeno es -2 (salvo en los peróxidos, en los que es -1).
- El número de oxidación de un ión simple coincide con su carga.
- En una sustancia simple, el número de oxidación de los átomos es cero.
- La suma de los números de oxidación de los átomos que constituyen un compuesto neutro, multiplicados por los correspondientes subíndices, es cero, o coincide con la carga del ión si se trata de un ión.
Criterios generales de formulación y nomenclatura
Por convenio, en las fórmulas de las sustancias se escriben primero los elementos de menor electronegatividad si se forman enlaces covalentes o los iones positivos si la sustancia es iónica (H2O, NaCl, CuSO4).
Para nombrar los compuestos se empieza nombrando el último elemento y se acaba por el primero: NaCl es cloruro de sodio.
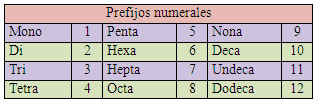 |
En la nomenclatura sistemática, para indicar la proporción estequiométrica de los
elementos en un compuesto se utilizan los prefijos numerales, que se añaden a
los nombres de los elementos a los que se refiere. Se mantienen todas las letras del prefijo (tetrahidruro de plomo), con una excepción: se dice monóxido.
También se utiliza el sistema de Stock, en el que se indica la valencia o número de enlaces formados por el elemento, que se escriben en números romanos entre paréntesis inmediatamente después de su nombre.
Números de oxidación
Aplica las reglas que acabas de ver sobre los números de oxidación para deducir si las afirmaciones siguientes son correctas.
Verdadero Falso
Verdadero Falso
Verdadero Falso
Formulación y nomenclatura en la web
En este tema vas a aprender a formular y nombrar los tipos de compuestos más habituales, y se te facilitan muchos ejemplos resueltos para facilitar tu trabajo.
De todos modos, en el sitio web del profesor Carlos Alonso puedes encontrar información que te ayude a resolver alguna duda que se te pueda plantear, ya que abarca muchos más contenidos de los que tú necesitas saber.