1.1 P, V, T y n
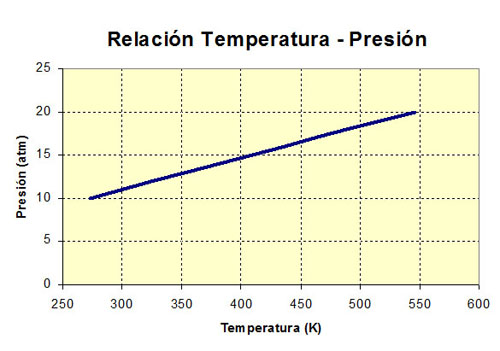
Relación entre la presión y la temperatura
Si se dispone de un recipiente de volumen fijo con una cantidad concreta de gas, se observa que al calentar el gas la presión aumenta proporcionalmente a la temperatura absoluta del gas. Es decir, si la temperatura se duplica, también lo hace la presión (P/T = cte, o Pi/Ti = Pf/Tf), con lo que la gráfica que relaciona ambas magnitudes es una recta.
 |
El cero absoluto de temperaturas
Abre el simulador y determina la temperatura a que se encuentra el aire en cada uno de los cuatro casos. Fíjate en lo que va haciendo la presión conforme la temperatura es menor.
Une todos los puntos con una regla y determina a qué temperatura se anula la presión. ¿Cómo estarán las partículas del gas a esa temperatura de cero absoluto?
Relación entre el volumen y la temperatura
 |
También puedes observar que si se calienta un gas que está en un recipiente de volumen variable, éste varía proporcionalmente al cambio de temperatura. Es decir, V/T = cte o Vi/Ti = Vf/Tf.
Por ejemplo, si colocas al sol un globo poco hinchado, observarás que se hincha a ojos vista. ¡Es muy fácil comprobarlo!
La representación gráfica de la variación del volumen frente a la temperatura también es una recta.
Influencia de la cantidad de gas
Si un recipiente cuya temperatura no varía se mantiene a volumen constante, cuanto más gas hay, más presión genera, y más volumen ocupa si lo que se mantiene constante es la presión. Por esa razón se hincha un globo si se inyecta más gas en él.
Se pueden resumir en una ley única: PV/T = cte. Las unidades pueden ser cualesquiera excepto para la temperatura, que debe expresarse necesariamente en la escala absoluta, en Kelvin.
Explicación de hechos experimentales
El curso pasado viste en la Física y química de 2º de ESO el modelo de la materia aplicado a los gases. Allí explicaste hechos que suceden en tu entorno de una forma muy sencilla; ahora acabas de ver cómo se explican mediante leyes numéricas experimentales, las leyes de los gases.
¿Recuerdas la explicación de los hechos que aparecen en las imágenes siguientes?

|

|

|

|
 |
 |
