1. Gases
 |
El estado gaseoso es el que más fácilmente se estudia, ya que para describir la situación de un gas que se encuentra en un recipiente cerrado basta con conocer cuatro magnitudes: la cantidad de gas (n), el volumen del recipiente (V), la temperatura a la que se encuentra (T) y la presión que produce (P).
La presión es una magnitud que mide la relación entre la fuerza realizada sobre un objeto y la superficie sobre la que se realiza. Utilizando el Sistema Internacional de unidades, se mide en pascales (Pa), pero es muy habitual medirla en los laboratorios en atmósferas (atm) o en milímetros de mercurio (mm o mm Hg).
Así, cuanto mayor sea la fuerza ejercida y menor la superficie sobre la que se realiza, mayor será la presión, ya que P=F/S.
A finales del siglo XVII ya se obtuvieron relaciones experimentales entre las magnitudes que caracterizan el estado de los gases (ley de Boyle, que relaciona la presión y el volumen), y se completaron posteriormente a principios del siglo XIX.
Relación entre la presión y el volumen: ley de Boyle
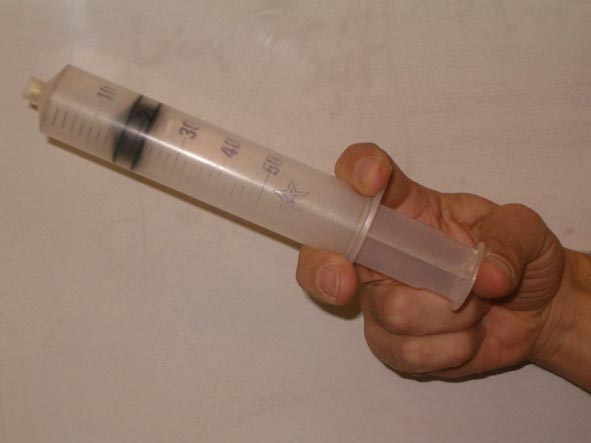 |
Cuando comprimes una jeringa hermética que contiene aire, cuya punta se ha sellado con una gota de pegamento, puedes observar que el volumen que ocupa el gas disminuye conforme vas empujando el émbolo de la jeringa, y que cada vez has de realizar mayor fuerza sobre la misma superficie del émbolo de la jeringa, lo que supone mayor presión.
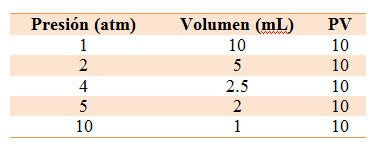
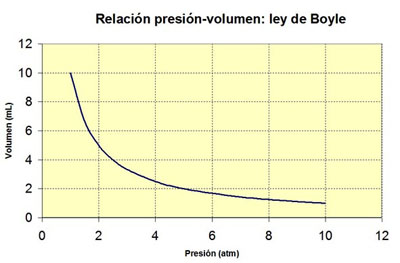
Observa la siguiente tabla de datos de presión y volumen, medidos en una situación experimental concreta en una jeringa, así como la gráfica que las relaciona. Si te fijas, el producto de la presión por el volumen es constante; es decir, puedes afirmar que:
En esta experiencia no cambia la cantidad de gas que hay dentro de la jeringa ni la temperatura a la que se encuentra el gas. Al realizar la experiencia con otra cantidad de gas o a otra temperatura, se mantiene la misma relación entre presión y volumen (su producto es constante), pero el valor de la constante varía.
 |
 |
Para determinar valores numéricos, solamente debes tener en cuenta que PiVi=PfVf donde i indica la situación inicial y f la final. Si de los cuatro valores sabes tres, es fácil determinar el que queda despejando en la expresión anterior.
¿Cuánto vale la constante en esta experiencia? Ten en cuenta las unidades en que se han medido el volumen y la presión.