1.1 Tipos de reacciones
Los tipos de reacciones más importantes son: síntesis, descomposición, sustitución y combustión. En el laboratorio vas a ver un ejemplo de cada una de ellas.
Hay otros tipos de
reacciones químicas, en función del tipo de sustancias que reacciona, como son
las reacciones entre ácidos y bases o las de oxidación y reducción, que verás
en cursos posteriores.
Síntesis del óxido de magnesio
En las reacciones de síntesis se obtiene una sustancia a partir de otras más sencillas.
magnesio (s) + oxígeno (g) → óxido de magnesio (s)
Mg (s) + O2 (g) → MgO (s)
En el vídeo puedes ver el proceso, en el que se forma el óxido de magnesio, que es una sustancia de color blanco, a partir de las sustancias elementales magnesio y oxígeno. Cuando se realice en el laboratorio, ten la precaución de no mirar directamente, ya que se emite una luz muy intensa. De hecho, reacciones como ésta se utilizan en los fuegos artificiales.
|
|
|
Descomposición del agua
En las reacciones de descomposición se obtienen varias sustancias a partir de una más compleja.
agua (l) → hidrógeno (g) + oxígeno (g)
H2O (l) → H2 (g) + O2 (g)
Fíjate en el montaje experimental. El aparato se llama voltámetro, y mediante el paso de la corriente eléctrica se produce la descomposición del agua, formándose el doble de volumen de hidrógeno que de oxígeno.
Precipitación por sustitución
En las reacciones de sustitución se intercambian los grupos de átomos que forman dos sustancias. En esta reacción se forma un sólido amarillo muy poco soluble (ioduro de plomo), que precipita al fondo del recipiente.
nitrato de plomo (ac) + ioduro de potasio (ac) → ioduro de plomo (s) + nitrato de potasio (ac)
Pb(NO3)2 (ac) + KI (ac) → PbI2 (s) + KNO3 (ac)
Añade dos o tres mililitros de cada disolución a sendos tubos de ensayo, y añade después uno sobre otro, observando la formación del precipitado. Si lo dejas en reposo en la gradilla, verás cómo el sólido va cayendo lentamente al fondo del tubo.
Si calientas el tubo de ensayo, verás que el sólido se disuelve (recuerda que la solubilidad aumenta con la temperatura). Pero si después lo dejas enfriar lentamente hasta temperatura ambiente, vuelve a precipitar, pero en forma de cristales muy brillantes, fenómeno que se conoce como lluvia de oro, y que puedes ver en la imagen.
Combustión del butano
En las reacciones de combustión una sustancia llamada combustible reacciona con oxígeno, formándose dióxido de carbono y agua. Los combustibles más utilizados son compuestos del carbono como metano, propano, butano, octano (gasolinas), etc. Estas reacciones se utilizan como fuente de energía: térmica al aprovechar el calor desprendido en el proceso, o bien transformándola en eléctrica en centrales térmicas.
butano (g) + oxígeno(g) → dióxido de carbono (g) + agua (l)
C4H10 (g) + O2 (g) → CO2 (g) + H2O (l)
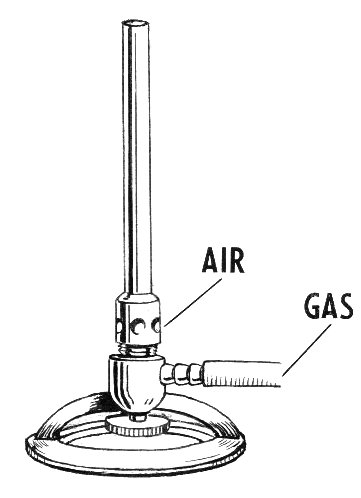
En el laboratorio se utiliza el mechero bunsen para calentar, y en él se quema gas butano. Tiene una válvula para regular la cantidad de gas que sale y se quema, y otra para controlar la cantidad de aire con la que se mezcla.
 |
 |
La respiración de los seres vivos
Para mantener vivo tu organismo y realizar las funciones propias de la vida diaria, tu cuerpo consume alimentos. En el proceso de digestión, esos alimentos se transforman en sustancias más sencillas, que son las que después se procesan para producir energía y mantener vivo el organismo.
a) Los alimentos ¿son reactivos o productos?
b) ¿Qué tipo de reacciones se producen en la digestión?
c) Considerando que el aire inhalado al respirar contiene un 20% de O2 y un 0,04% de CO2, y el espirado un 16% de O2 y un 4% de CO2, clasifica los dos gases en reactivo o producto.
 |
Los metales tienen diferente reactividad frente a agentes atmosféricos como el aire o el agua. Los objetos elaborados con los diferentes metales se destruyen más o menos según sea su reactividad: los más reactivos quedan más deteriorados.
Realiza la actividad siguiente para identificar el metal de que están hechos varios metales, utilizando como criterio su grado de deterioro por acción del agua.