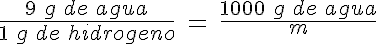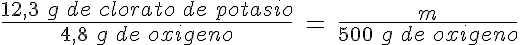4.1 Cálculos en masa
Este es el aspecto realmente práctico. Por ejemplo, para saber en una industria metalúrgica cuánto hierro se obtiene por kilogramo de óxido de hierro que reacciona. Ese hierro se utilizará después para obtener acero, con el que se fabrican objetos de todo tipo como tubos, depósitos para líquidos, cuberterías, etc.
 |
 |
Este curso vas a realizar los cálculos sin utilizar las ecuaciones químicas. Tendrás como datos la proporción de combinación, mientras que en la Física y química de 4º de ESO obtendrás la proporción a partir de la ecuación que representa la reacción química.
En realidad, ya has aprendido a hacerlos al aplicar las leyes de las reacciones químicas (2.2). Los reactivos y productos ya no serán A, B, C, etc, sino que se tratará de sustancias concretas, pero la forma de plantear y realizar los cálculos será la misma.
Obtención de hidrógeno
El hidrógeno probablemente sea el combustible del futuro. Partiendo de un kg de agua, ¿cuánto hidrógeno se puede obtener? Ten en cuenta que cuando reaccionan lo hacen en la proporción de 1 g de hidrógeno por cada 8 g de oxígeno.
Azúcar caramelizado
 |
El clorato de potasio (KClO3) se ha utilizado para producir oxígeno en el laboratorio, ya que a alta temperatura se descompone en KCl y O2.
Cuando se produce la reacción en un tubo de ensayo, calentando fuertemente hasta que el clorato funda, y se añade una sustancia azucarada como una gominola, ésta arde rápidamente, debido a la alta temperatura y al oxígeno desprendido en la reacción química.
Como la reacción puede ser peligrosa porque se pueden producir proyecciones de sustancias muy calientes, la experiencia la hará el profesor.
Si prestas un poco de atención, ¡te darás cuenta de que acaba oliendo a caramelo quemado!