2.1 Energía de red
Cuando se forma NaCl a partir de sus elementos se desprende una gran cantidad de energía (¿recuerdas el vídeo con la llamarada producida?). En concreto, 411 kJ por mol formado de esa sustancia iónica. Sin embargo, para llegar a tener un mol de iones Na+ y otro mol de iones Cl- es necesario comunicar 377 kJ, ya que hay que sublimar el sodio, disociar el cloro e ionizarlos para formar Na+ y Cl-.
Por tanto, cuando interacciona un mol de iones Cl- con un mol de iones Na+ y se distribuyen formando la red iónica se desprende la energía necesaria para compensar los 377 kJ comunicados y que se desprendan 411 kJ; en definitiva, se desprenden 788 kJ debido a la interacción de los iones. Ese es el valor de la energía de red del NaCl.
 |
 |
Observa la característica forma cúbica de los cristales de la sal común: los iones sodio y cloruro se distribuyen unos alrededor de otros, adoptando la forma que se ve la derecha (red cúbica centrada en las caras y en las aristas).
Energía de red
La energía de red es la energía desprendida al formarse un mol de sustancia iónica a partir de los iones en estado gaseoso, y es una medida de la intensidad de las interacciones entre los iones: cuanto mayor es la energía de red, mayores son las fuerzas interiónicas.
Se han medido los valores de la energía de red de los compuestos iónicos conocidos, y se ha analizado de qué factores depende. Teniendo en cuenta la interacción electrostática entre los iones y el tipo de red (cómo se distribuyen espacialmente los iones), se ha propuesto la ecuación de Born-Landé, que de forma simplificada se puede escribir como:

en la que A es una constante que depende del tipo de red, z+ y z- son los valores absolutos de las cargas de los dos iones de la sustancia (1 y 1 en el NaCl) y r+ y r- sus radios.
Factores que influyen en la energía de red
Fíjate en la expresión de la energía de red. Cuanto mayor sea la carga de los iones, con más fuerza interaccionan entre ellos, y será más difícil destruir la red: mayor será la energía de red.
Si los radios de los iones son menores, están más cerca entre sí, con lo que interaccionan con más fuerza, y la energía de red será más grande.
Fíjate en la siguiente tabla de datos:
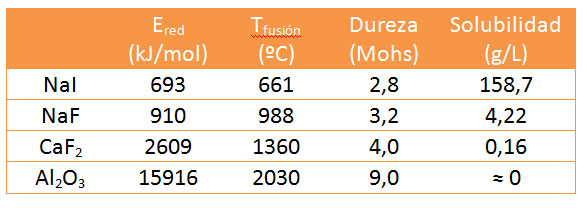
Puedes observar que la energía de red es mayor al aumentar las cargas de los iones y al disminuir su tamaño, que también influyen en que la red iónica sea más compacta y la constante A sea mayor.
En la tabla siguiente puedes ver las energías de red experimentales de todos los haluros alcalinos.
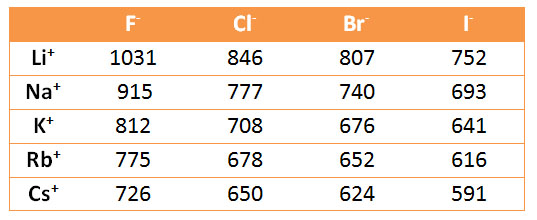
Energía de red de los haluros alcalinos
A partir de los datos de la tabla anterior, justifica los valores mayor y menor de la energía de red de los haluros alcalinos.
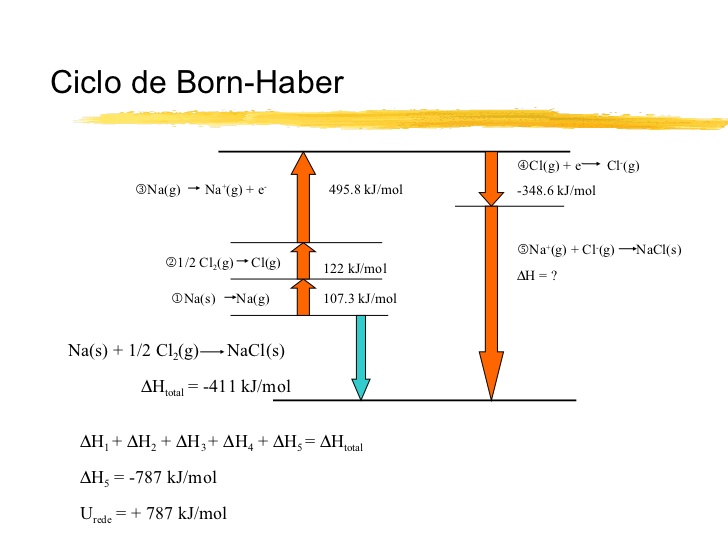
El ciclo de Born-Haber
Observa la imagen, en la que se representan las distintas reacciones que intervienen en la formación de un cristal iónico de NaCl (el ciclo de Born-Haber).
Fíjate en que la reacción puede producirse de forma directa o en fases: sublimar el sodio (1), disociar el cloro (2), ionizar ambos átomos (3 y 4) y permitir que interaccione una gran cantidad de los iones formados para dar lugar a la sustancia iónica (5). La energía desprendida en este último paso se llama energía de red).
Suponiendo que conoces las variaciones de entalpía de todos los procesos, excepto la energía de red, aplica la ley de Hess para determinar la energía de red a partir del resto de datos.