9.1 Sustancias iónicas
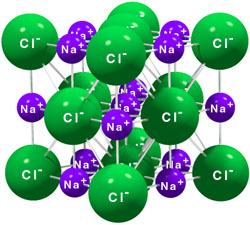 |
Las propiedades de las sustancias dependen de la estructura que tienen a escala de partículas. En las sustancias iónicas los iones se unen mediante intensas fuerzas electrostáticas, que se manifiestan en todas las direcciones del espacio y que generalmente son muy intensas. Los iones de un signo esán rodeados por iones de signo contrario, y así sucesivamente, estableciéndose un equilibrio entre las fuerzas atractivas que se producen entre iones de signo contrario con las repulsivas que hay entre iones del mismo signo.
La magnitud que determina las propiedades es la energía de red: cuanto mayor sea, más energía se desprende al formarse la sustancia iónica, y más energía es necesario comunicar para destruirla (fundirla, rayarla, disolverla, etc).
Los iones no están en reposo, sino que debido a la agitación térmica producida por la temperatura a la que se encuentra la sustancia oscilan dentro de un espacio reducido. Al calentar la sustancia, esta agitación térmica va siendo mayor.
Debido a la intensidad de esas fuerzas, los puntos de fusión son medios o altos, ya que para que los iones se separen por agitación térmica hay que alcanzar temperaturas elevadas. De esta forma, todas las sustancias iónicas son sólidas a temperatura ambiente.
Por la misma razón, en general, son sustancias duras, ya que no es fácil separar iones: al rayar una sustancia, se separan algunas de las partículas que la forman, por lo que se deben vencer las fuerzas que las mantienen unidas en el sólido.
No conducen la corriente eléctrica en estado sólido, ya que los iones ocupan posiciones fijas en la red, pero sí lo hacen fundidos o en disolución, ya que en ese caso los iones tienen una cierta movilidad (la corriente eléctrica consiste en partículas cargadas que se mueven en la misma dirección y sentido a lo largo del cable conductor).
  |
Cuando se golpea un cristal iónico se produce un desplazamiento de las capas iónicas. Observa en la gráfica cómo inicialmente los iones de un signo rodean a los de otro, mientras que por efecto del golpe quedan enfrentados iones del mismo signo, con lo que las fuerzas repulsivas aumentan notablemente, y la estructura se abre por una zona de corte prácticamente perfecto: el cristal puede llegar a hacerse añicos si el golpe es lo bastante fuerte. En consecuencia, son sustancias frágiles.
Energía de red y propiedades de las sustancias iónicas
Observa la tabla siguiente:

Basándote en los valores de la energía de red, justifica la secuencia de valores en las tres propiedades.
|
A: NaCl y 801ºC; B: NaI y 661ºC
| |
|
A: NaCl y 661ºC; B: NaI y 801ºC
| |
|
A: NaI y 801ºC; B: NaCl y 661ºC
| |
|
A: NaI y 661ºC; B: NaCl y 801ºC
|
Solubilidad
Una última propiedad interesante es la solubilidad en líquidos polares, del tipo del agua, pero su solubilidad es muy variable, desde grande a prácticamente nula, dependiendo de las características tanto de la sustancia iónica como del disolvente. Obviamente, cuanto mayor sea la energía de red, menor será la solubilidad.
Observa la animación, en la que se simula el proceso de disolución de un cristal iónico en agua. Los iones pasan del sólido a la disolución, de manera que las interacciones ión-ión se rompen, estableciéndose interacciones entre los iones y las moléculas de agua. Cuanto más débiles sean las interacciones entre iones (menor sea la energía de red), más fácilmente se disolverá la sustancia iónica en agua.
|
|
