3.4 Hipótesis de Avogadro
En 1805, Gay-Lussac observó que se cumplía una relación de combinación que también era constante, pero que se daba exclusivamente entre gases: los volúmenes que reaccionan de dos gases que están a las mismas condiciones de presión y temperatura lo hacen en una relación de números enteros sencillos.
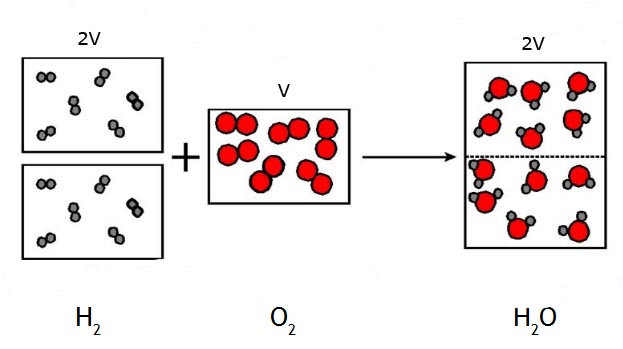
Por ejemplo, cuando el hidrógeno reacciona con cloro, lo hacen volúmenes iguales para dar un volumen doble. Y si reacciona un volumen V de oxígeno lo hace con un volumen 2V de hidrógeno para dar un volumen 2V de agua.
Para explicar estos hechos experimentales, Avogadro supuso que volúmenes iguales de gases distintos, en las mismas condiciones de presión y temperatura, contienen el mismo número de partículas: es un planteamiento que utiliza el modelo de partículas de la materia.
|
|
El concepto de molécula
Además, Avogadro introdujo el concepto de molécula. Observa el diagrama de partículas siguiente, que corresponde a la reacción entre hidrógeno y cloro para dar ácido clorhídrico.
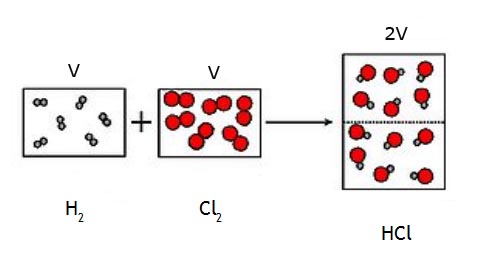 |
Si el cloro y el hidrógeno fuesen monoatómicos, se formaría el mismo volumen de ácido clorhídrico que el que había reaccionado de cada gas. La única forma de explicar que el volumen formado sea doble es suponer que ambos reactivos están formados por partículas que tienen dos átomos iguales, por moléculas biatómicas.
 |
La descomposición del agua
Cuando el agua se descompone por acción de la corriente eléctrica, se observa que se desprende el doble de volumen de hidrógeno que de oxígeno, como se ve en la imagen.
Dibuja un diagrama como el anterior para la formación del agua, en el que se representen los volúmenes de gas combinados y las moléculas que intervienen en la reacción.